接種時期選定の参考 (新)


3-1-2-1.抗原(こうげん)
3-1-2-2.抗体(1)
3-1-2-3.抗体の種類
3-1-2-4.親和性成熟とクラススイッチ
3-1-2-5.抗体(2)
「3-1-1.自然免疫と獲得免疫」では、抗原とは免疫系が敵味方の識別に用いている印(小さな分子)のこと だと説明しました。
ここではもう少し詳しく見ていきましょう。
次図は炭素原子の構造図(中学校レベル)です。
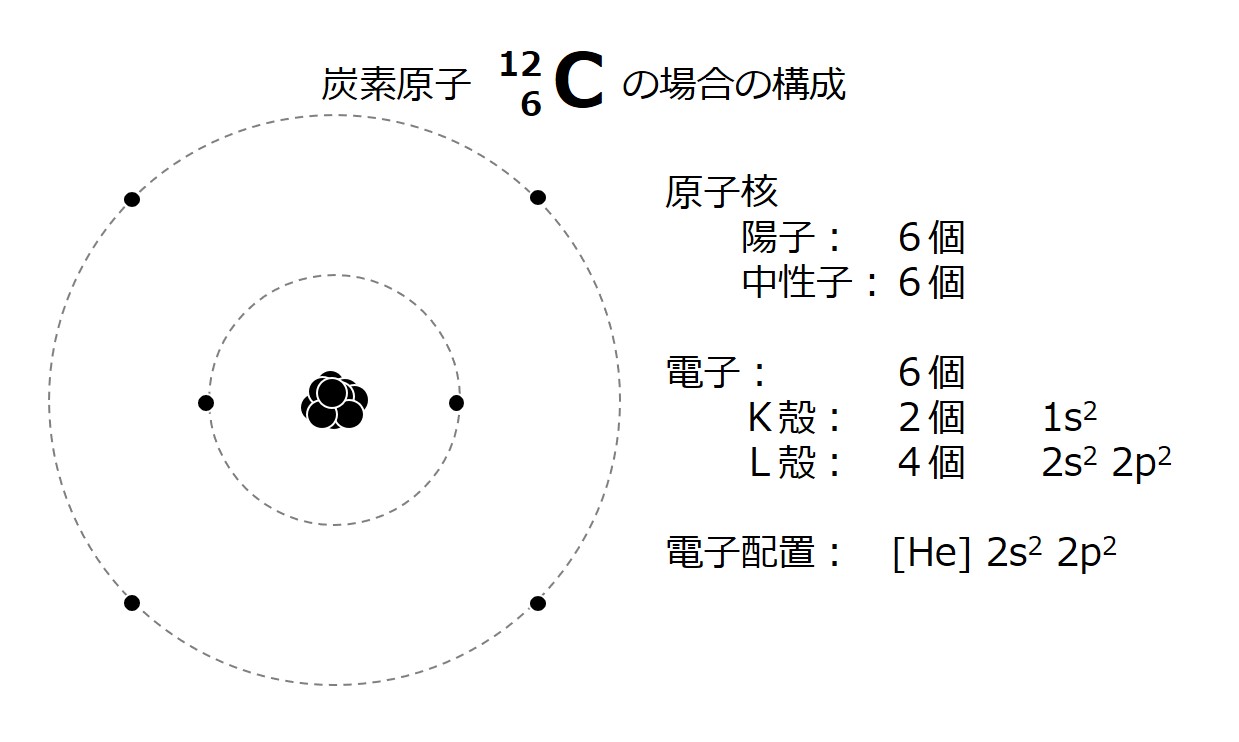
「2S22P2」のような表記は高校レベルかも知れません。電子の分布は層を形成していて(電子殻)、原子核に近い側から「K殻、L殻、M殻、・・・」と呼ばれていることを思い出すことができれば大丈夫です。
化学反応を担っているのは、いちばん外側にある電子です(最外殻電子)。
炭素原子の場合は、そのような最外殻電子が 4 個あります。
原子核の陽子1個は「+1」の電荷を持ち、原子核の周りにある電子1個は「-1」の電荷を持っているので、プラスとマイナスの電荷を合計すると次図のように、1個の炭素原子の電荷は「0」=「電気的に中性」となります。
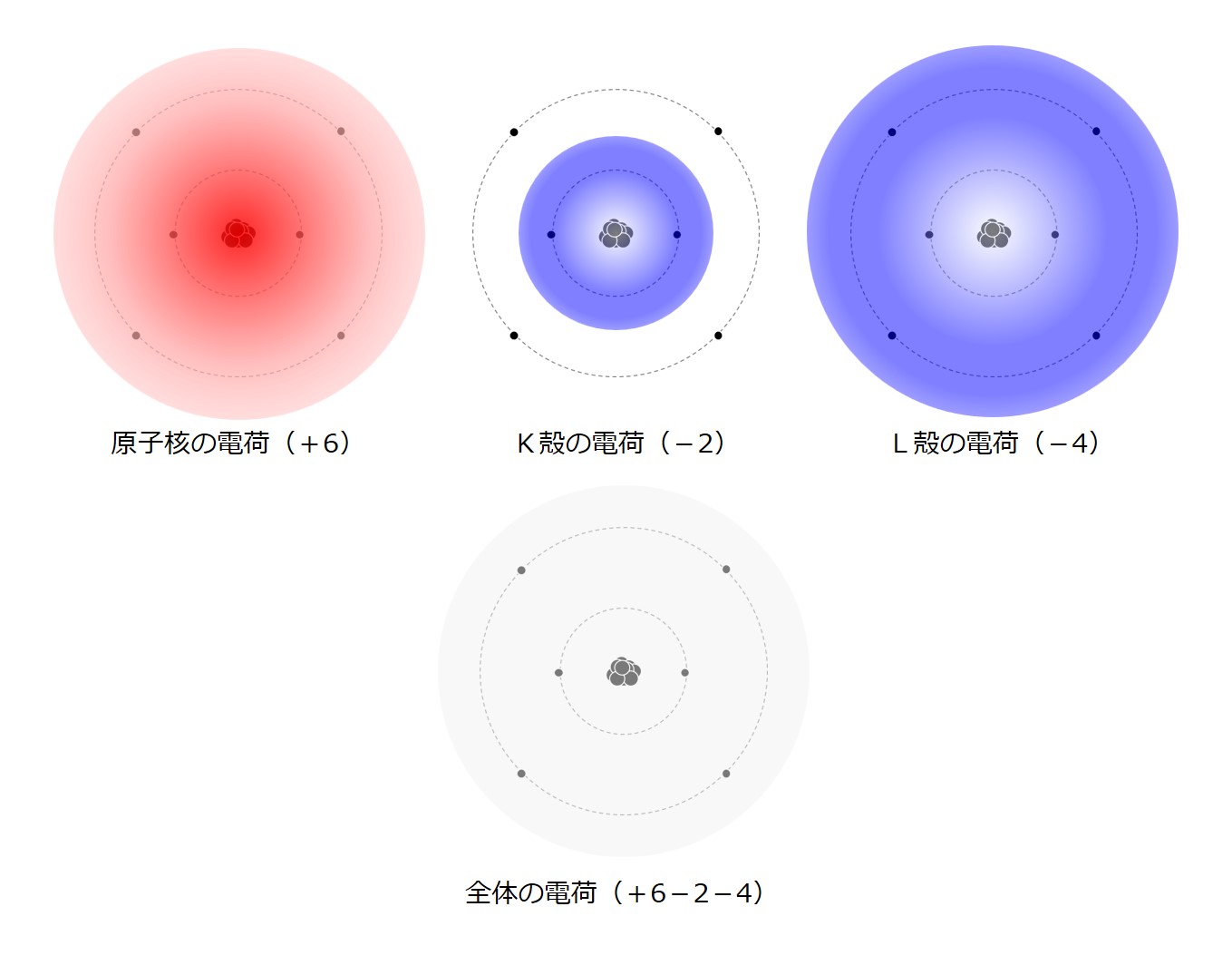
しかし、電荷の分布は「波打ち揺らいで変化し続ける雲のような」ものらしいので、化学的な活性に乏しいという意味では「ノペーとして動かない静かな海」をイメージしていてもよいのでしょうが、実際には次図の右のように、無数の小さな「+」と「-」が交互に出たり引っ込んだりしている様子をイメージしたほうが良いようです。

免疫の説明なのに、いきなり陽子や電子の話が出てきて驚かれるかもしれませんが、抗体と抗原の結合は電気的な結合なので、物質の表面にある電荷について「量子力学っぽいイメージ」を持てるか確認しておくことは重要なのです。
しかし、ここで覚えないといけないことは、特に何もありません。
さて、抗原は、脊椎動物で発達した獲得免疫系が自らの身体に属する細胞(つまり仲間)と病原体などの外敵とを明確に識別するための印であるという話に戻ります。
免疫系は、数十個 ~ 数百個の原子が集まった小さな分子の表面にできる電荷の(4次元で変化していく)分布パターン を、そのような印として用いています。
ここでは、もっとも一般的な抗原である「ペプチド抗原」を説明します。
生物のタンパクの骨格部分(要するに主要部分)は、20種類のアミノ酸が鎖(くさり)のように1列につながったものです(・・・自然界に天然のアミノ酸は何百種類とあるようです)。
そのアミノ酸のつながった一本鎖が、クネクネと折れ曲がったり、ねじ曲がったりしながら、適当に糖をくっつけたり、折れ曲がりで近づいたアミノ酸同士が手を結びあったりして複雑な「ひとかたまり」となったものが「タンパク」です。
アミノ酸は次のような構造を持っています。生き物のタンパクを構成するアミノ酸では「R:側鎖」の部分が20種類あります。(C:炭素、O:酸素、N:窒素。H:水素)
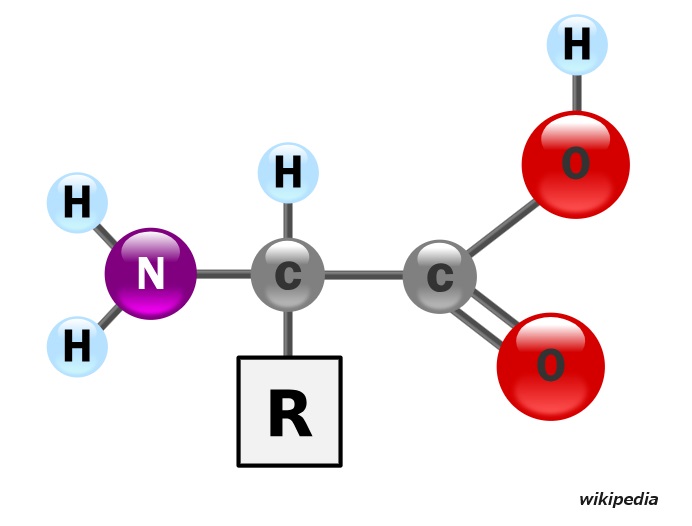
炭素原子は最外殻であるL殻に4個の電子を持っています。そこで4つの方向に腕を伸ばして他の原子と結合することができます(・・・もちろん、覚えておく必要はありません・・・)。
アミノ酸の構造を次図のように描き直します。炭素原子から出る4本の腕の先には「水素、アミノ基、カルボキシ基、側鎖(20種類のどれか)」がついています。
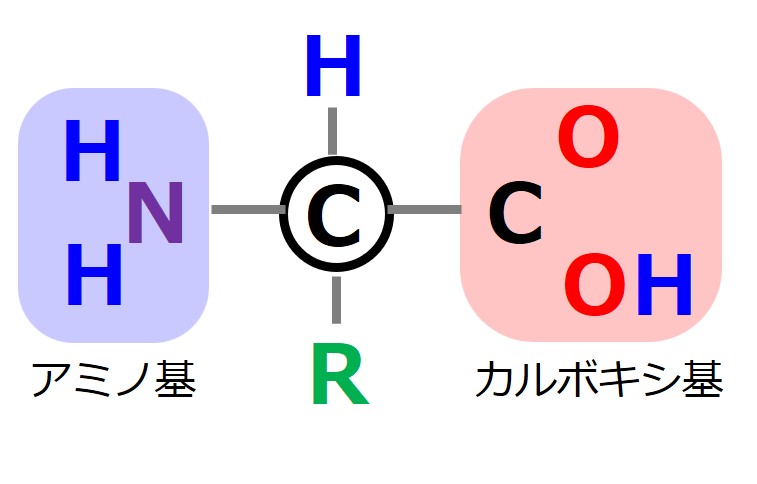
「水素、アミノ基、カルボキシ基、側鎖(20種類のどれか)」は、炭素の4本の腕のどこに置いても良いというわけではありません。
立体的に描かれた構造を見ると、その意味がわかるでしょう。
下図で「アミノ基→カルボキシ基」向きに見たときに側鎖(R)が左側にあるか右側にあるかを確かめてみましょう。
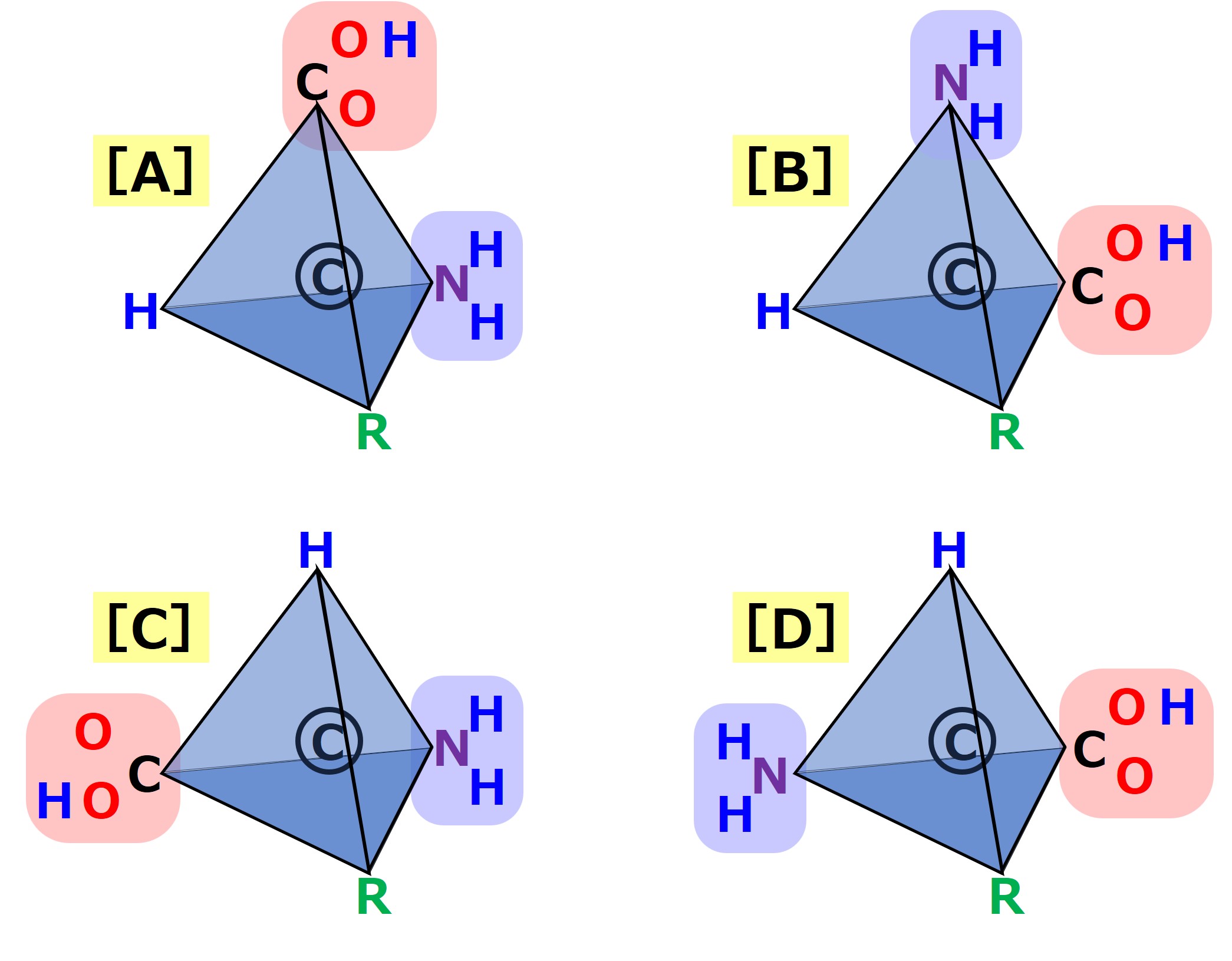
上図の「AとD」、「BとC」は、それぞれ同じ構造です。
これを鏡像関係と呼び、アミノ酸は「L体」と「D体」とで区別されます。
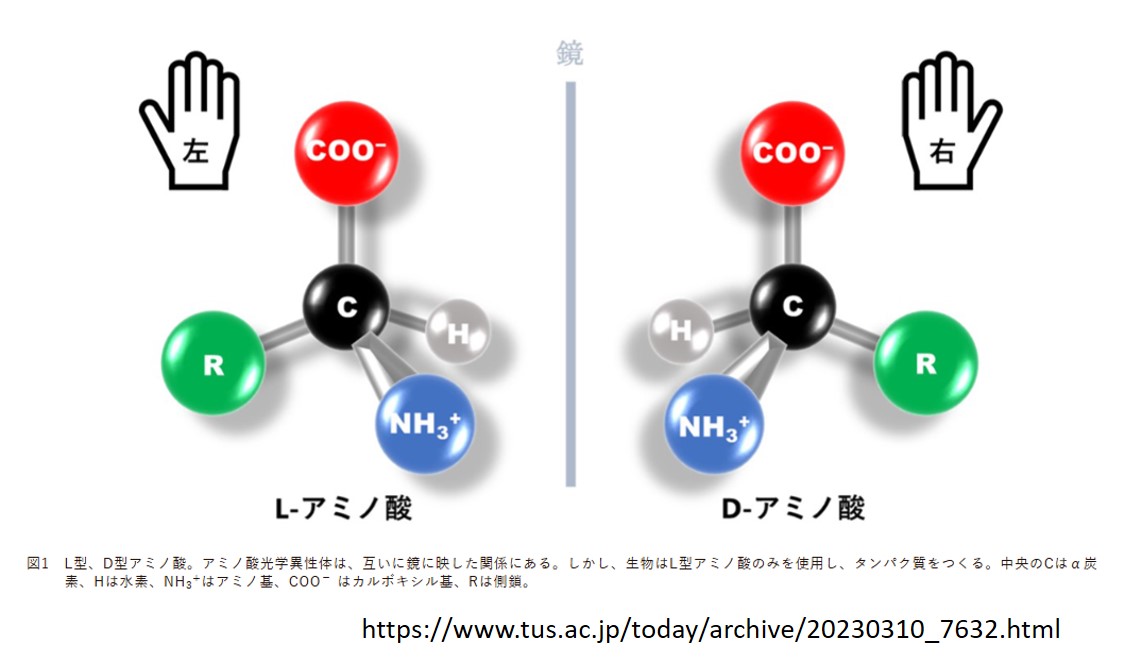
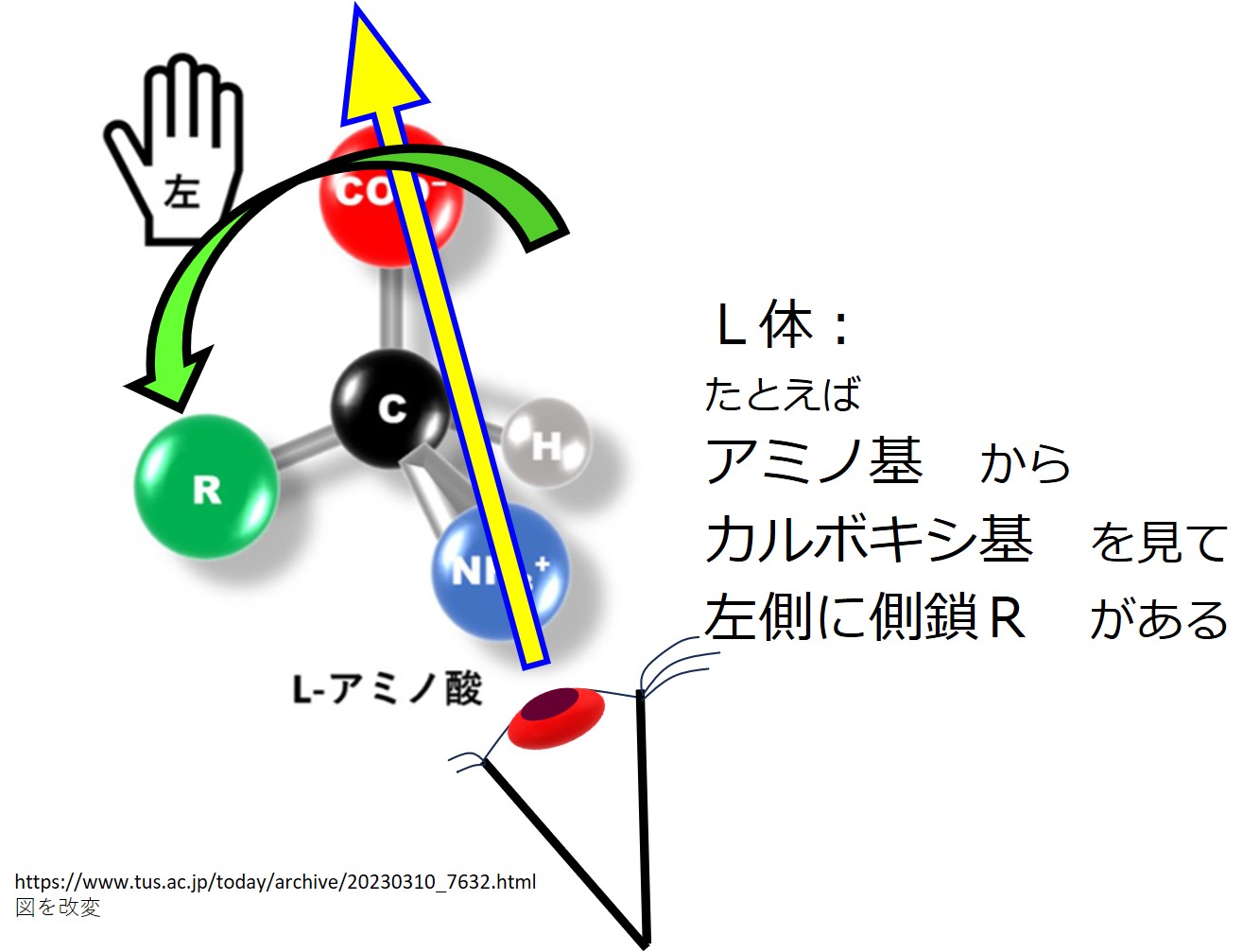
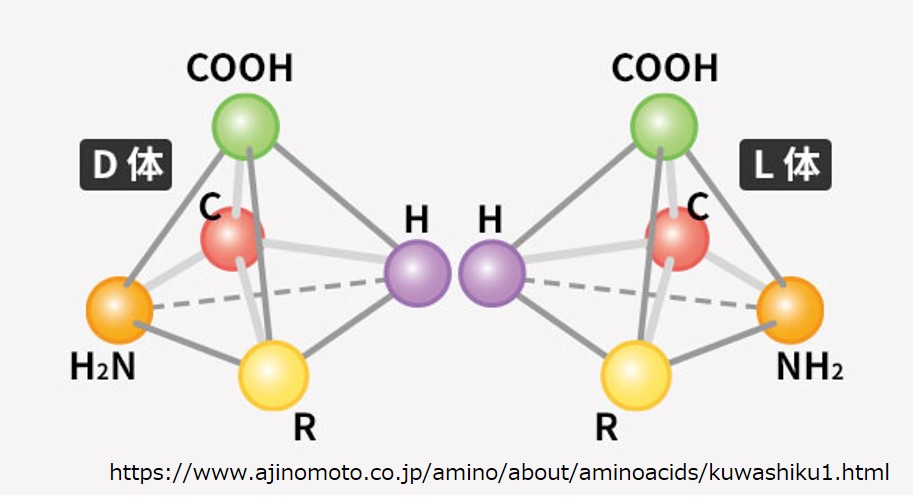
たとえば、Hからカルボキシ基を見て炭素Cが左側にあるのがL体であり、右側にあるのがD体です。しかしこれはL体、D体の定義ではなく、ここでの便宜的な説明にすぎません。厳密には分子の光学的な性質に基づいて定義されています。
生き物のタンパクで使われているのは、ほとんどが「L体」なので、覚える必要はありませんし、鏡像関係を空間的に理解できなくても困ることはありません。
カルボキシ基の水素原子(構成しているのは陽子1個と電子1個)の陽子は、電子を残してお隣のアミノ基へ行ったり戻ったりしているようです。
酸素の原子核や窒素の原子核の電子を引き寄せる引力に違いがあり、このようなことが起こっているようです。
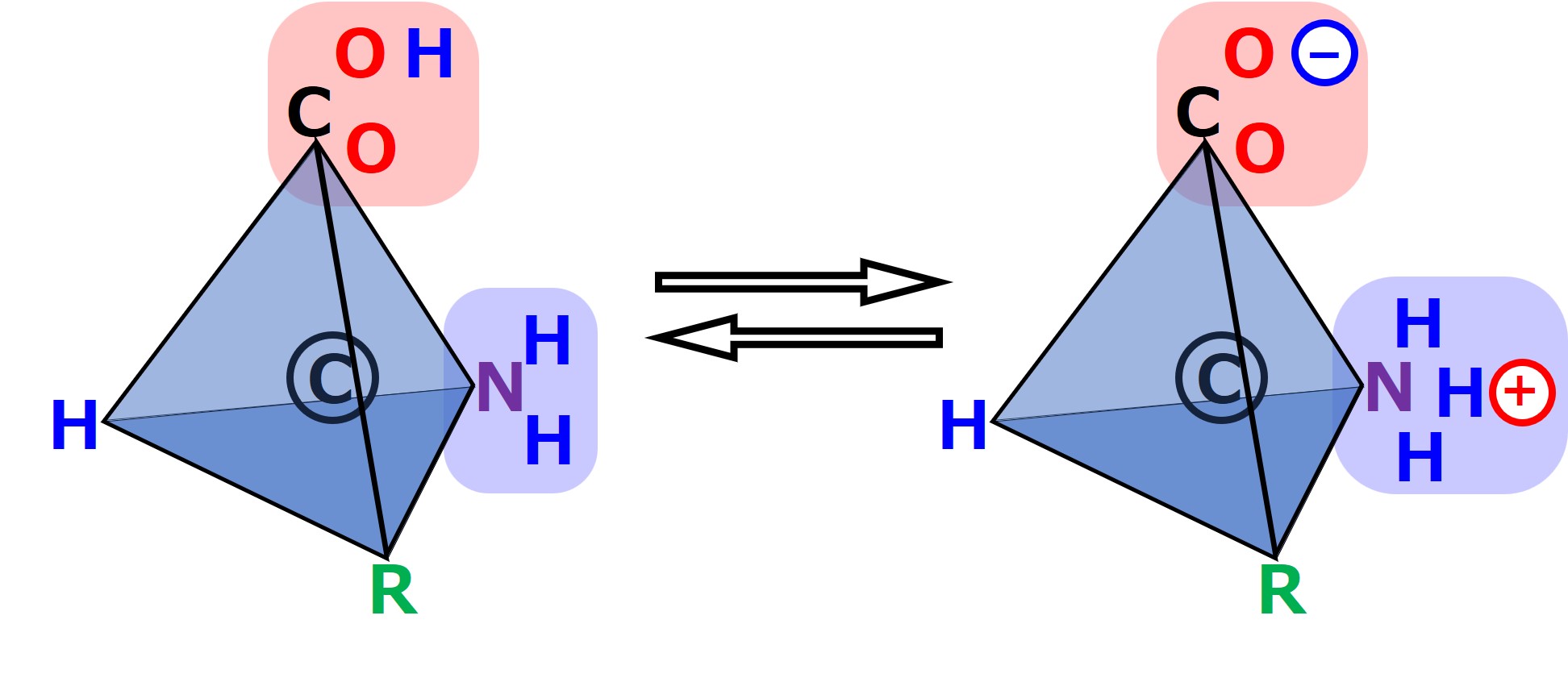
こうしてアミノ酸1個の分子の表面で「 + 」の強い部分や「 - 」の強い部分など、電気的な偏りが生じるので、お隣のアミノ酸と電気的に反発し合ったり、引き寄せ合ったりもします。
分子は忙しいのです。特に、電子や水素の原子核(陽子)は身軽なので動きまくっています。
次図のように、電気的に偏ったアミノ基とカルボキシ基は引き寄せ合います。
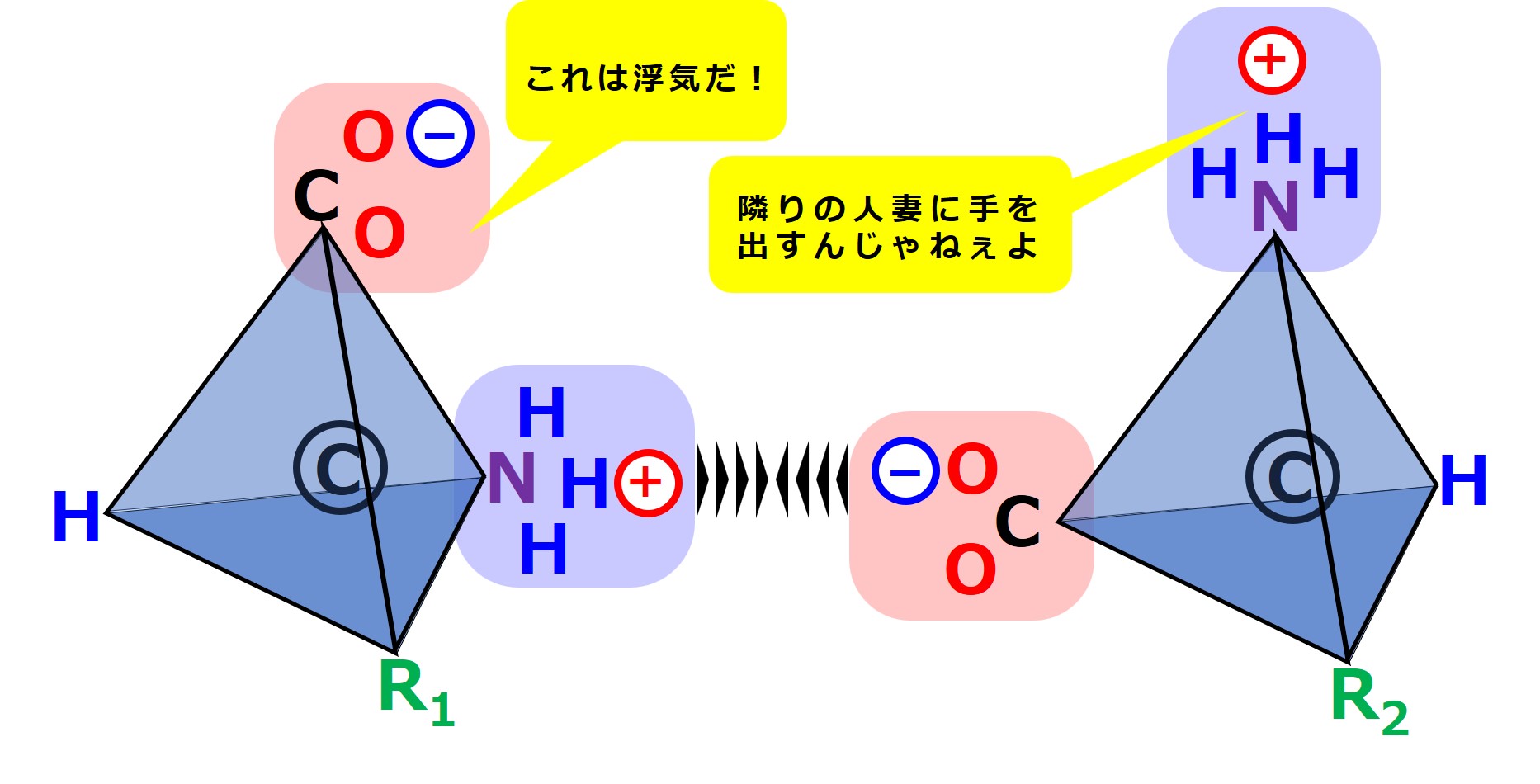
こういう2人の間に「酵素(こうそ)」と呼ばれる仲人(なこうど)が現れると、邪魔な水分子を取り除いて結合させてしまいます。
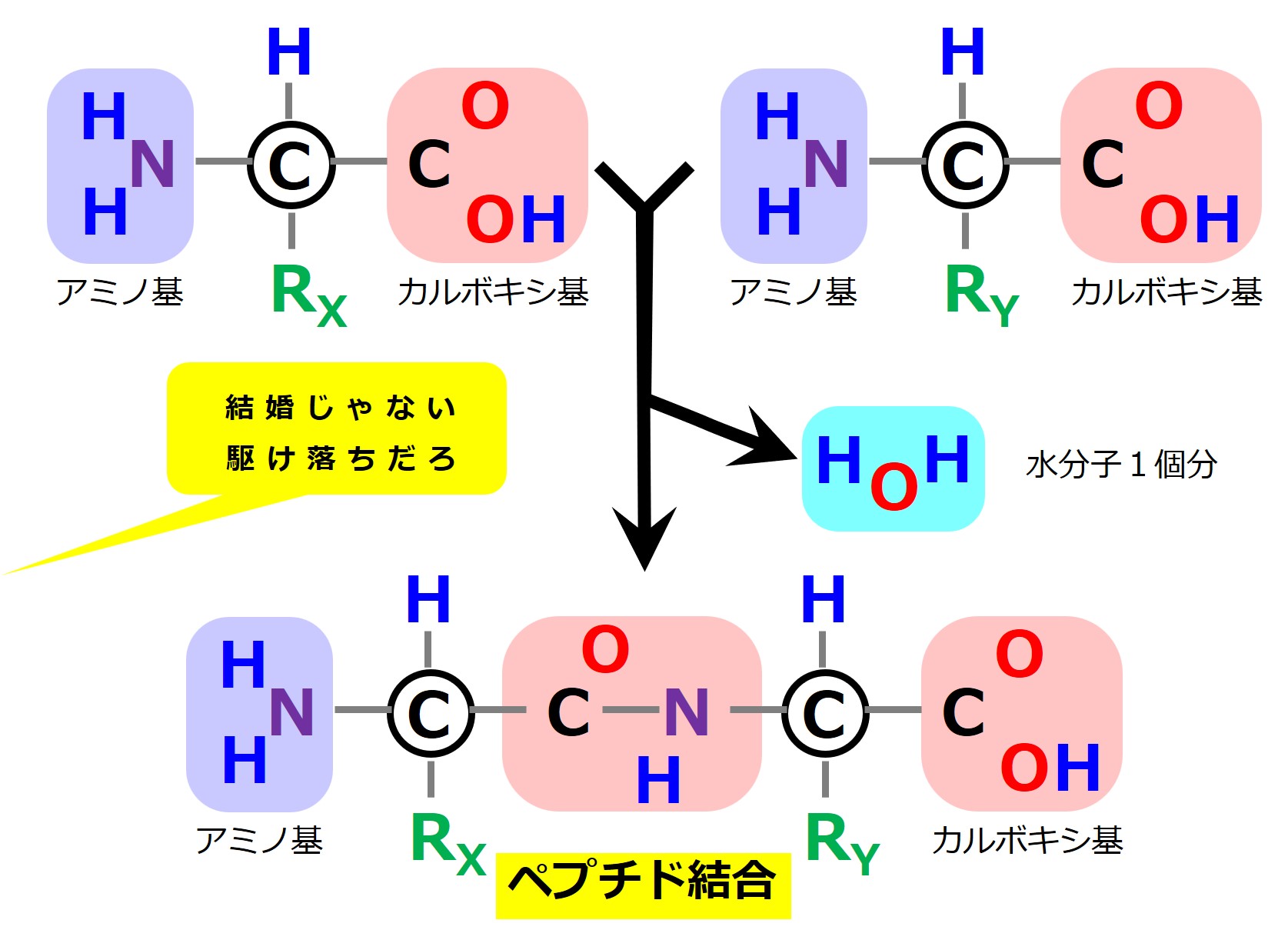
アミノ酸2個がガッチリとつながりました。こうなると、そう簡単には別れることができません。
同じようにして、アミノ酸は3個、4個、5個、・・・何百個、何千個と鎖のようにつながっていくことができます。
生き物が使う20種類のアミノ酸の中には、アミノ基を2個持つものやカルボキシ基を2個持つものもありますが、細胞内での「DNA → RNA → タンパク」の流れの中では基本的に枝分かれすることなく1列につながります。
2個以上つながったアミノ酸のことを「ペプチド」と呼びます。
ここでは、「ペプチドとはどのようなものか」が理解できれば十分です。
「ペプチド結合」を覚える必要はありません。「ペプチド」という言葉を覚えてください。他に覚えておく必要のあるものは何もありません。
ここで、どんなアミノ酸があるのか、サラッと見ておきましょう。
自然界にアミノ酸の種類はたくさんあるけれども、生き物が利用しているのはたった20種類なのです。
参考:アミノ酸とは?(日本分光 JASCO)
アミノ酸の分類のページを見ると、「酸性アミノ酸」、「中性アミノ酸」、「塩基性(アルカリ性)アミノ酸」といった分類方法も示されています。
要するに、アミノ酸の種類ごとに表面の電荷分布が異なっていて電気的な性質に特徴がありますよ、ということです。
アミノ酸を見たついでに、タンパクの構造もサラッと見てみましょう。
参考:【優しすぎる解説】たんぱく質の構造についてまとめてみた!
参考:タンパク質の構造
さて、免疫系は適当な長さのペプチドを抗原として扱っています。
抗原提示で使われる抗原やB細胞受容体(抗体)と結合する抗原の長さは、だいたい次表のようです(アミノ酸の個数で長さを表しています)。
| 抗原のチェック | ペプチド抗原の長さ |
| (1)食細胞 → ヘルパーT細胞 | 10 ~ 30 個 |
| (2)食細胞 → キラーT細胞 | 8 ~ 11 個 |
| (3)すべての体細胞 → キラーT細胞 | 8 ~ 11 個 |
| (4)抗原 → B細胞受容体との結合 | 5 ~ 8 個 |
「ペプチド抗原の長さ」:「新しい免疫入門」(審良静男・黒崎知博 講談社 2014)などより
抗原提示(表の1~3)で使われているペプチド抗原と、抗体が結合するペプチド抗原(表の4)は、長さだけでなく、立体構造的な面でも大きな違いがありますが、それは「3-1-3.抗原提示」のところで紹介します。
ここでは、抗体(B細胞受容体)に結合するペプチド抗原について説明します。
次のような、アミノ酸6個が結合したペプチドがあるとします。

実際に抗体が見ている抗原の姿は、次図のようなもの(あくまでイメージ)です。
ペプチドの分子表面の電荷の分布、おそらく時間の経過とともに揺れ動き変化していることも含めた電荷の4次元的な分布形を抗体は見ています。
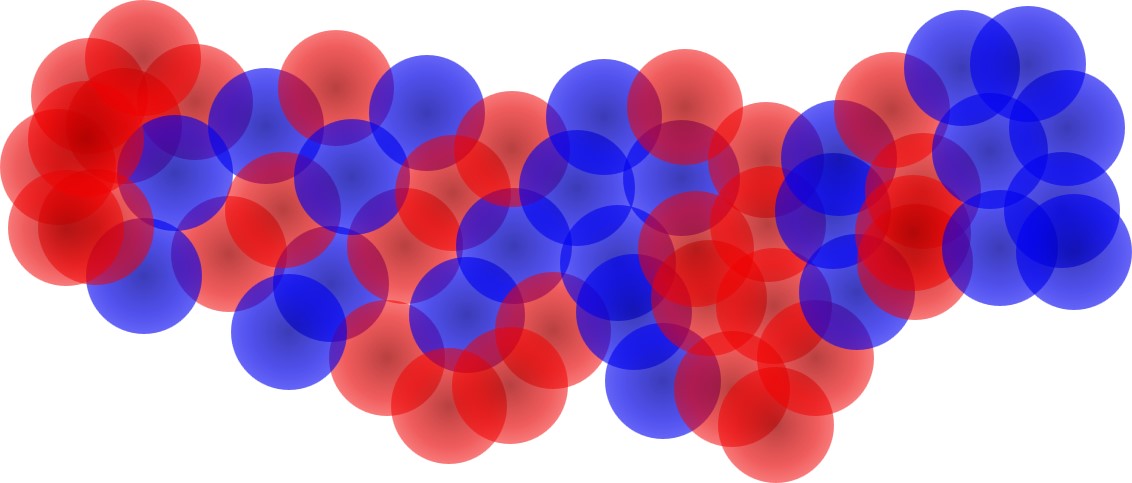
抗体は、ペプチド抗原のアミノ酸配列順序(2次元の情報)などは見ていないということです。
抗体が見ているのは、タンパクの中で折れ曲がったり、ラセン状にくねったりしているペプチドの立体的な構造の表面における電荷分布の状態です。
もしここに抗原を認識する部分の電荷分布が次のようになっている抗体があれば、上記の抗原にピタッと結合するでしょう。
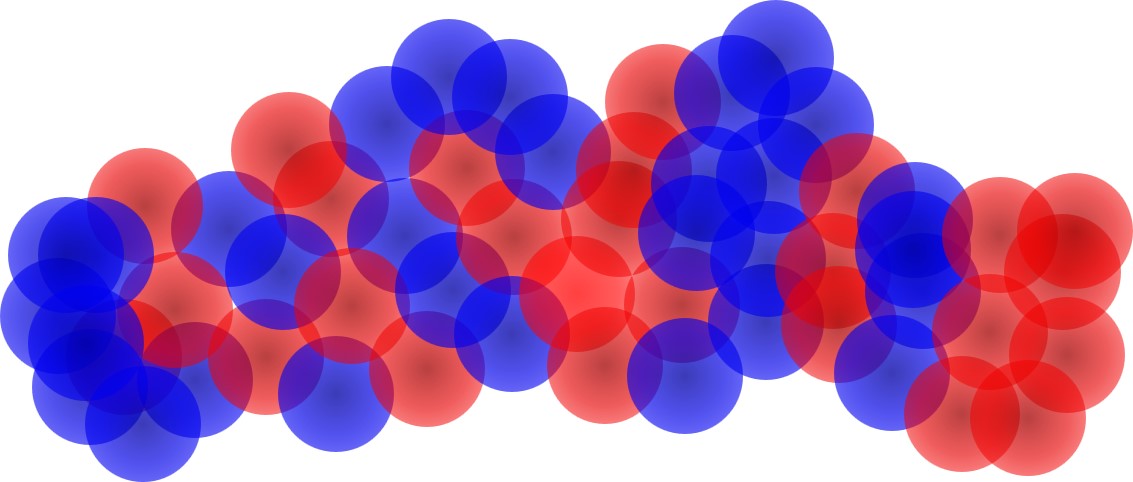
わかりにくいので反転すると次図になります。

実際には、これほどピタリと電気的な「+と-」が補完しあってガチガチに結合するような抗体が作られることはめったにありません。
「+と-」が少々ズレていても、ほどほどの強さで結合できれば抗体としての役目を果たすことができます。
そのため、たとえば「酸性アミノ酸」が別の「酸性アミノ酸」に入れ替わっただけで大きな構造の変化がないペプチドには、「同じ抗体の結合できる可能性」があります。
抗体が結合するのは、タンパクを構成しているペプチドです。
したがって、立体構造を持っています。
もし何らかの理由でタンパクの中でのペプチドの構造が(たとえば次図のように)変化した場合、もはやこれまでの抗体はこのペプチド抗原に結合できなくなります。

ペプチド抗原を構成するアミノ酸の配列順序は変わっていなくても、立体的な配置の変化により表面の電荷分布の状態が変わってしまうからです。
抗原提示で使われるペプチド抗原の場合は、タンパクをバラバラに分解して切り出したペプチド抗原なので、こうしたタンパク内部での構造変化の影響を受けにくく、アミノ酸配列に変化が無ければペプチド抗原としての品質が保たれます。「3-1-4.T細胞受容体」で扱います。
さて、アミノ酸が何百個とつながってタンパクができている時、適当な長さのペプチドであれば、すべてが「抗原性」を持っていますが、そのほとんどは自身の身体を構成する他のタンパクのペプチドと同じであり(つまり自己抗原です)、「敵としての抗原性」は持っていません。
病原体のタンパクであっても、「敵の標識として使える抗原性」をもつペプチドの部分はたくさんありません。
こうした「敵としての抗原性」を持つペプチド抗原を「エピトープ」と呼びます。
「抗原決定基」とか「最小抗原単位」などと呼ぶこともあります。

しかし、自己免疫性疾患などでは自己抗原に対する抗体がたくさん作られます。
こうした抗体が結合するペプチド抗原も「エピトープ」と呼びます。
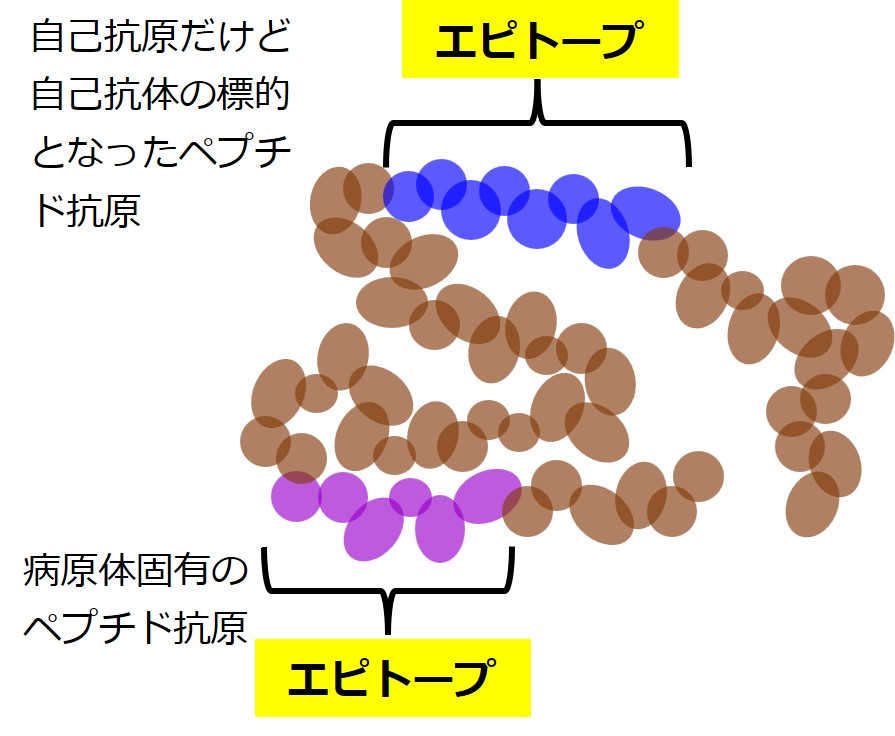
生物がもつあらゆるタンパクの、あらゆるペプチド(アミノ酸:5~8個)は、抗体(B細胞受容体)が結合できる「抗原性」を持っているという意味で「ペプチド抗原」と呼ぶことができます。
そうしたペプチド抗原のうち、免疫系が多量に産生している抗体の結合するものを「エピトープ」と考えるとよいでしょう。
しかし、細胞性免疫で ヘルパーT細胞 や キラーT細胞 が敵として認識するペプチド抗原(アミノ酸:8 ~ 30 個)も「エピトープ」と呼ぶようです。
「エピトープ」の意味は。これ以上拡大しないと考えられます。
要するに、自己抗原だろうと、他者抗原だろうと、免疫系が「敵」と認識して攻撃する「印」となっている特別なペプチド抗原が「エピトープ」です。
炭素原子から始まった 抗原 antigen の説明で、最終的に覚えておいて欲しいのは、「ペプチド peptide」と「エピトープ epitope」のふたつだけです。
また何らかの説明文中に「抗原」と出てきたときは、それが特定の1個のエピトープを意味しているのか、複数のエピトープを持つタンパクのひとかたまりを意味しているのか、注意が必要です。
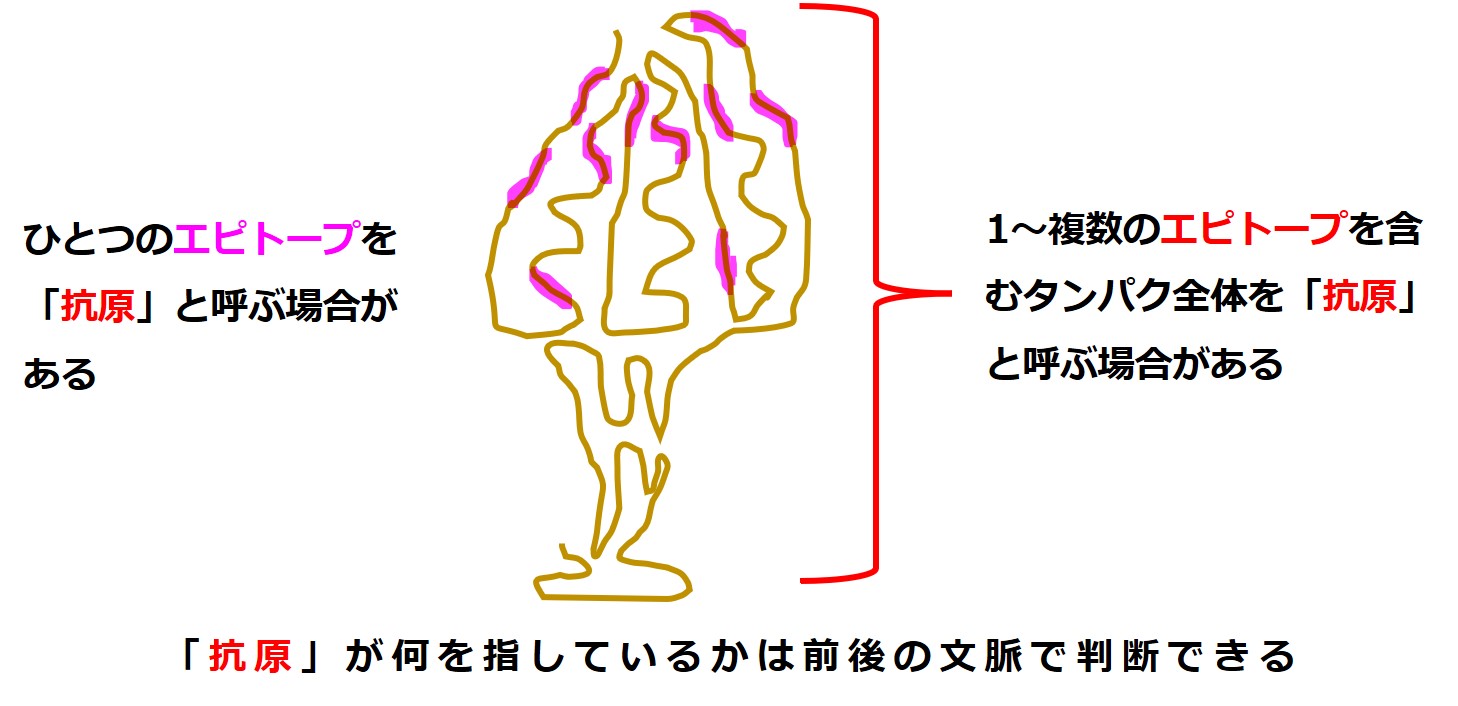
「抗原」という言葉が持つ狭い意味、広い意味が何となく理解できたでしょうか。
最も狭い意味では、「抗原 antigen 抗体 antibody 結合」の関係を持ち、抗体(B細胞受容体)のくっつく物が抗原ということになります。
この「3-1-2-1.抗原」では、そうした抗原のうち、特にペプチド抗原について説明しました。コロナワクチンのメリット・デメリットを考えていくうえで重要な抗原だからです。
広い意味では、「抗原」は、T細胞受容体が結合する「MHC+抗原」の抗原を含みます。これについては「3-1-3.抗原提示」、「3-1-4.T細胞受容体」で説明します。
しかし、自然免疫に属する食細胞(マクロファージや樹状細胞、好中球など)などは抗原に相当する「病原体関連分子パターン」というものに、抗体に相当する「病原体関連分子パターン認識受容体」というものが結合して、食べた病原体の識別に用いています。
病原体関連分子パターン(PAMPs:Pathogen Associated Molecular Patterns)には、ヒトの細胞には無い「細菌やウイルスのDNAやRNA、細菌に特有のリポ多糖やリポタンパクなど」が含まれています。
特別な修飾を施していないmRNAワクチンを投与すると、「パターン認識受容体」に見つかってすぐに処分されてしまいます。
こうしたパターンを認識する受容体の働きは、抗体の働きの元祖のようなものですが、抗体よりも発見が百年遅かったので、B細胞受容体やT細胞受容体とは別の扱いを受けています。
「パターン認識受容体」は免疫細胞だけでなく、全細胞で見つかっており、21世紀初めに自然免疫の大きな見直しが行われたようです。
「パターン認識受容体」は食細胞の表面(細胞膜上)や、分解されたものを運ぶエンドソーム(運送業者のような細胞内小胞)の内側などに配置されています。
食べ物を見つけると、食細胞はその細胞膜の一部を袋状(コップのような形状)にして食べ物を包み込み丸呑みします。このとき、細胞膜上にあったパターン認識受容体は袋の内側を向いていますが、食べているものが何かを分析します。続いて食べ物を包む袋にリソソーム(消化液の入った胃袋小胞)が融合し、消化液で食べ物を分解します。こうした細胞内小胞の内側には、細胞膜上にあるものとは別種のパターン認識受容体があり、小胞の内容物に細菌やウイルスのDNAやRNAがないかを調べます。病原体のパターンを見つけたとき、食細胞は活性化し、免疫応答を開始します。
ここでは、食べられるものは何でも食べる自然免疫系も、食べている最中に「あれっ? 何を喰っているんだろう?」、また食べた後で「あれっ? 何を喰ったんだろう?」と敵味方の大まかな識別をしているということは、なんとなく覚えておいてもよいでしょう。
もちろん忘れても問題ありませんが、mRNAワクチンのメリット・デメリットを考えるうえでは結構重要な知識です。自然免疫系が異物を喰って終わりではなく、病原体を認識するパターン認識受容体を持っていることは、よっぽど凶悪なウイルスでない限り、自然免疫系だけで十分にやっつけることができる能力を持っている可能性を示唆しています。
そして、コロナウイルスはそういうウイルスです・・・換気をして室内のウイルスを減らす、時と場所に応じてマスクを着用し吸い込むウイルスの数量を少なくする、過度のストレスを避けて免疫力を落とさないなど・・・きちんと予防策を採れば自然免疫系だけで撃退できるウイルスです・・・だからmRNAワクチンのメリット・デメリット、また何をどのように接種すればメリットを大きくできるのかをよく研究する必要があるわけです。
「3-1-1.自然免疫と獲得免疫」では、抗原とは免疫系が敵味方の識別に用いている印(小さな分子)のこと だと説明しましたが、現在の免疫学は自然免疫系を除いて定義しているので「抗原とは獲得免疫系が敵味方の識別に用いている印(小さな分子)」ということになります。
抗体とは、抗原に特異的に結合する(=抗原を認識する)受容体のことです。
抗体を作るのは リンパ球のB細胞 です。

骨髄(こつずい)で生まれたB細胞は、抗体作りの開始と同時に幾重もの厳しい試練を受けることになります。その試練を乗り越えて、良い抗体を作れると認められたごく一部だけが プラズマ細胞(形質細胞) に昇格して、抗体の大量生産をおこないます。
プラズマ細胞になるまでは、B細胞は抗体を細胞膜上に配置しています。この段階の抗体は B細胞受容体(B細胞抗原認識レセプター) と呼ばれます。
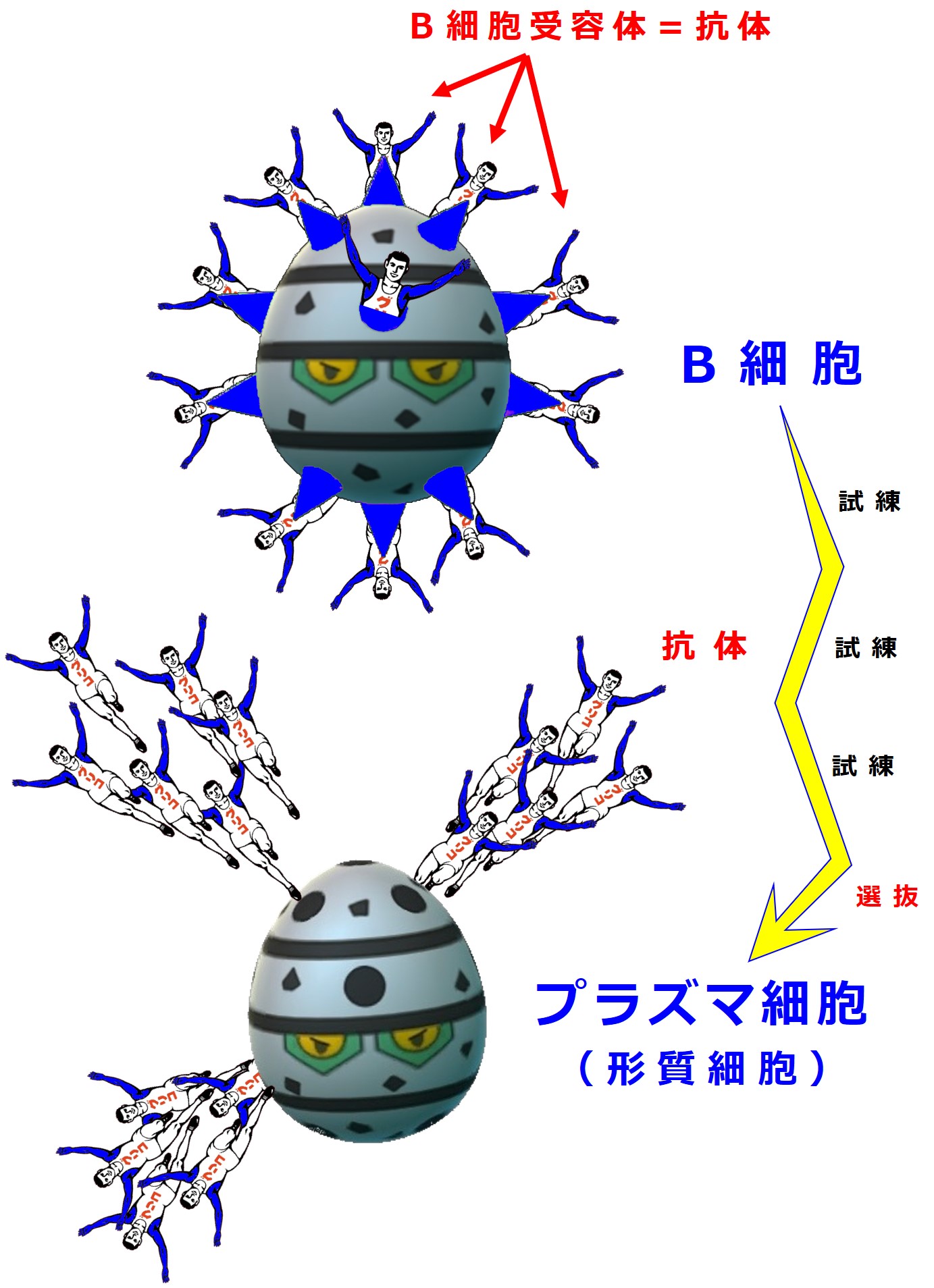
B細胞がプラズマ細胞になって抗体を大量産生するようになるまでに受ける試練は大きく2段階あります。
| 試練の場所 | チェックの内容 |
| 骨髄 | 作ったものがちゃんと抗体の形をしていること |
| 自己抗原とは結合しないこと | |
| リンパ節 | 病原体の抗原としっかり結合すること |
チェックを受けて不合格だとB細胞は殺されることが多いので、なかなか厳しい試練です。
以下は、むかし作った「パッと見てわかる手抜き説明」の改良?版です。
抗体(基本形)は、こんな形や構造をしています。
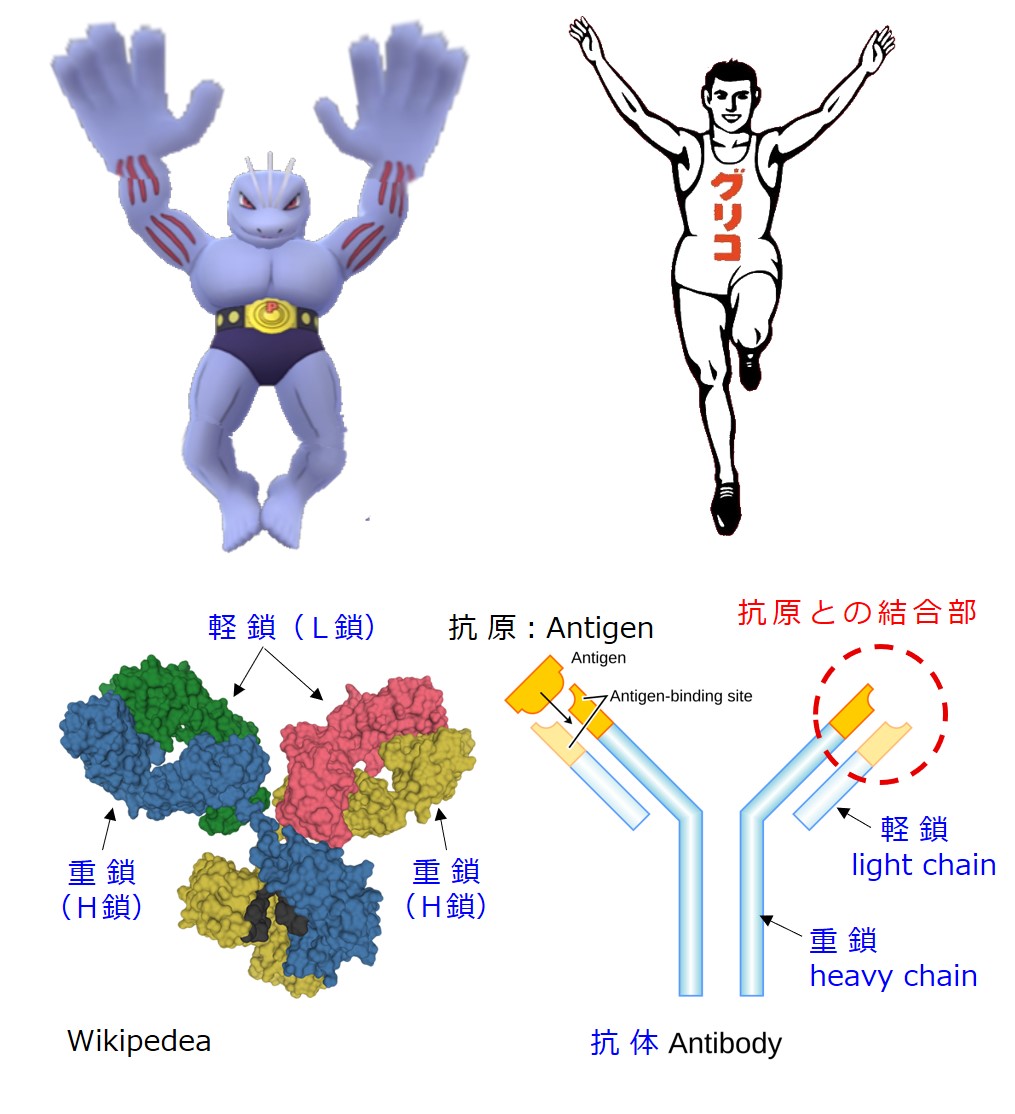
いちいち英語を確認する必要はありません。参考までに載せています。
Antibody:抗体
Antigen:抗原、図ではエピトープのことです
Antigen-binding site:抗原(エピトープ)が結合する部位
抗体のY字型簡易表記では、重鎖の外側に軽鎖を描いたり、重鎖の内側に軽鎖を描いたり、いろいろです。
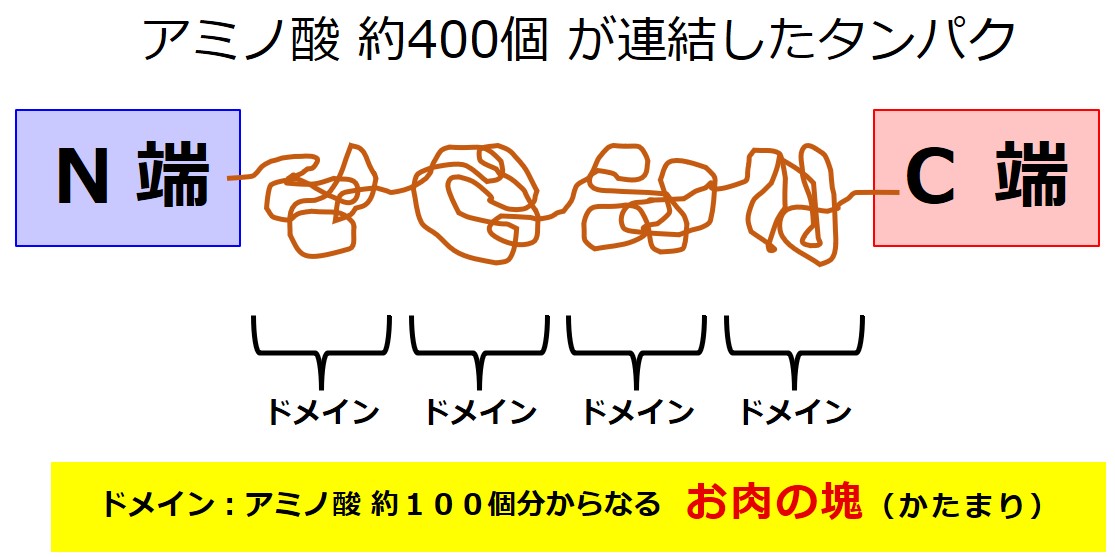
抗体の分子モデル(上図↑)は、幾つもの「肉のかたまり」がつながっているように見えます。
ひとつの肉の塊はアミノ酸約 100 個からできています。
この、肉の塊のひとつひとつを ドメイン と呼びます。
ドメイン はわりとよく出てくるので、ここで説明しておきます。
アミノ酸5個が1列に連結して鎖のようになったとき、下図↓のようになります。
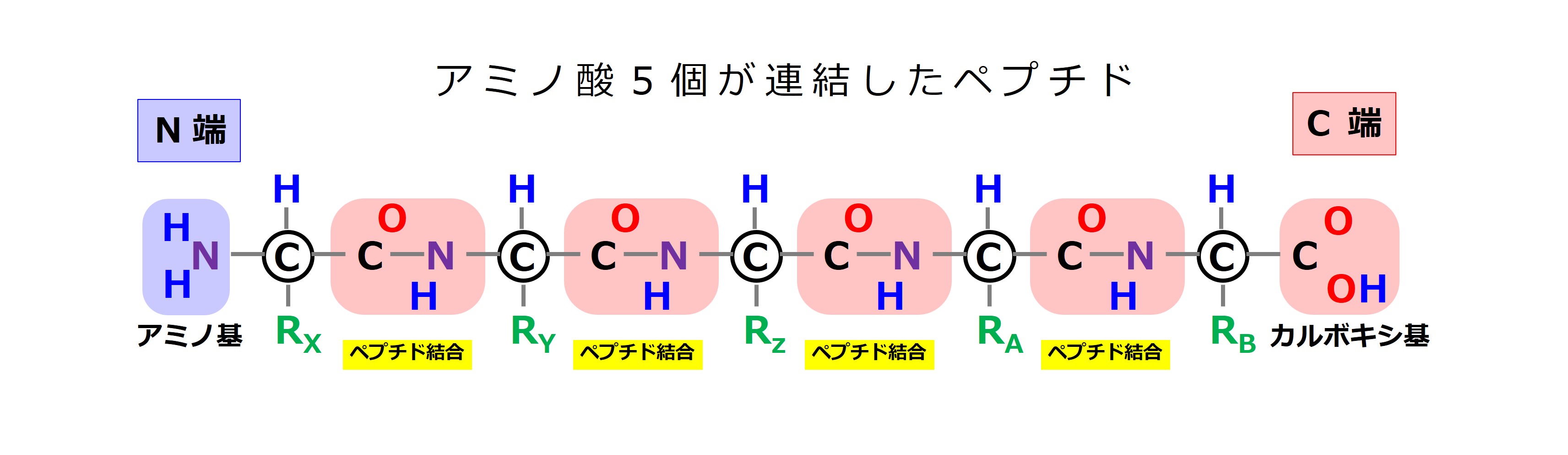
ペプチド結合などは、「3-1-2-1.抗原(こうげん)」で説明したばかりですが、何も思い出せなくても大丈夫です。アミノ酸が1列に結合してタンパクの基本骨格ができること、アミノ酸が2個以上つながったものを ペプチド と呼ぶことだけ覚えておけば十分です。
ペプチドの両端のうち、ひとつはアミノ基(N端)、ひとつはカルボキシ基(C端)となり、鎖の向きがわかります。
アミノ基(N端)もカルボキシ基(C端)も覚える必要はありません。ペプチドには「向きがある」ということだけ知っていれば大丈夫です。
さて、ここにアミノ酸約 400 個が連結したペプチドが作られたとします(こんなに大きいときは ポリペプチド と呼ぶこともあります)。

アミノ酸がペプチド結合で1列に連結して長い鎖のようになったものはタンパクの基本骨格となります。
ポリペプチドは折り曲げられます。折り曲げられると少し離れたアミノ酸同士が近づきます。ペプチド結合以外の、アミノ酸同士を弱く結合する色々な方法を使って、「お肉のかたまり」のようなものが作られていきます。
お肉のかたまりの大きさは、色々ありますが、抗体だとだいたいアミノ酸 100 個分が「ひとかたまり」となります。
この「お肉のひとかたまり」を ドメイン と呼びます。
下図↓は、抗体をドメイン(domain)ごとに分けて表示しています。
ごちゃごちゃ書いているのは無視してください。ドメイン(お肉のかたまり)が連なっているのが分かればそれでかまいません。
重鎖 heavy chain と軽鎖 light chain の区別は重要です。抗体のどの部分が重鎖(H鎖)であり、どの部分が軽鎖(L鎖)なのかは理解しておいたほうが良いでしょう。
ひとつの抗体は、別々に作られた重鎖(H鎖)と軽鎖(L鎖)が合体して作られます。
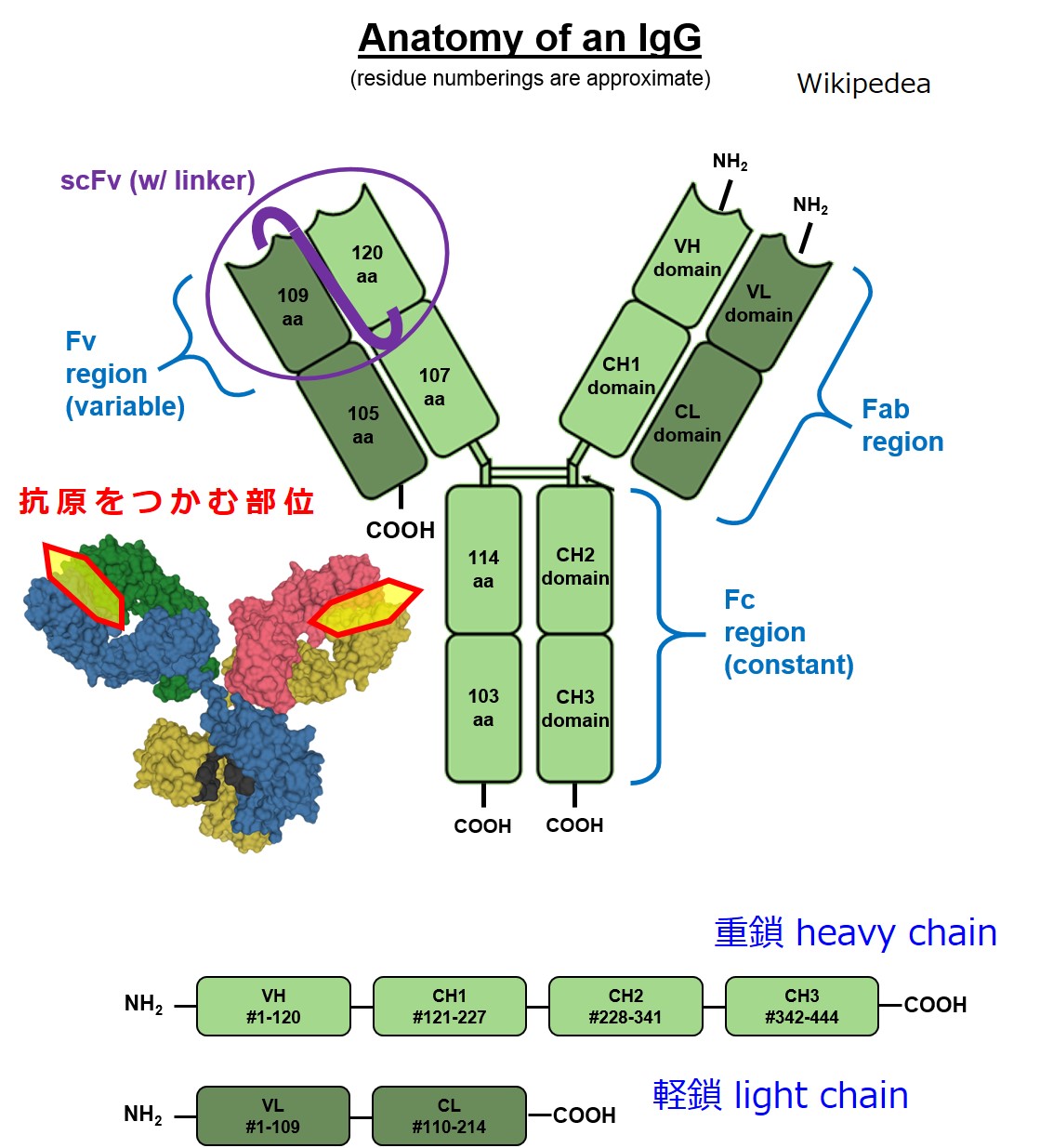
英語は参考
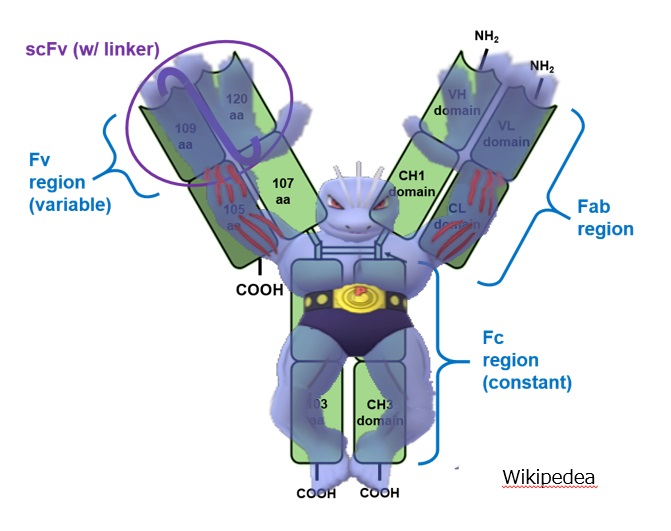
H:heavy chain 重鎖
L:light chain 軽鎖
V:variable 変化に富む、可変性の
C:constant 変化の少ない、定常的な
F:fragment 断片
Fv:variable 変化に富む、可変性の
Fab:antigen-binding 抗原に結合する
Fc:clystalline 結晶になる
重鎖 heavy chain の定常部分は「α、δ、ε、γ、μ(ギリシャ文字で アルファ、デルタ、イプシロン、ガンマ、ミュー)」の5種類あります。
ドメイン(肉のかたまり) を ウインナーソーセージ風に描くと下図のようになります。
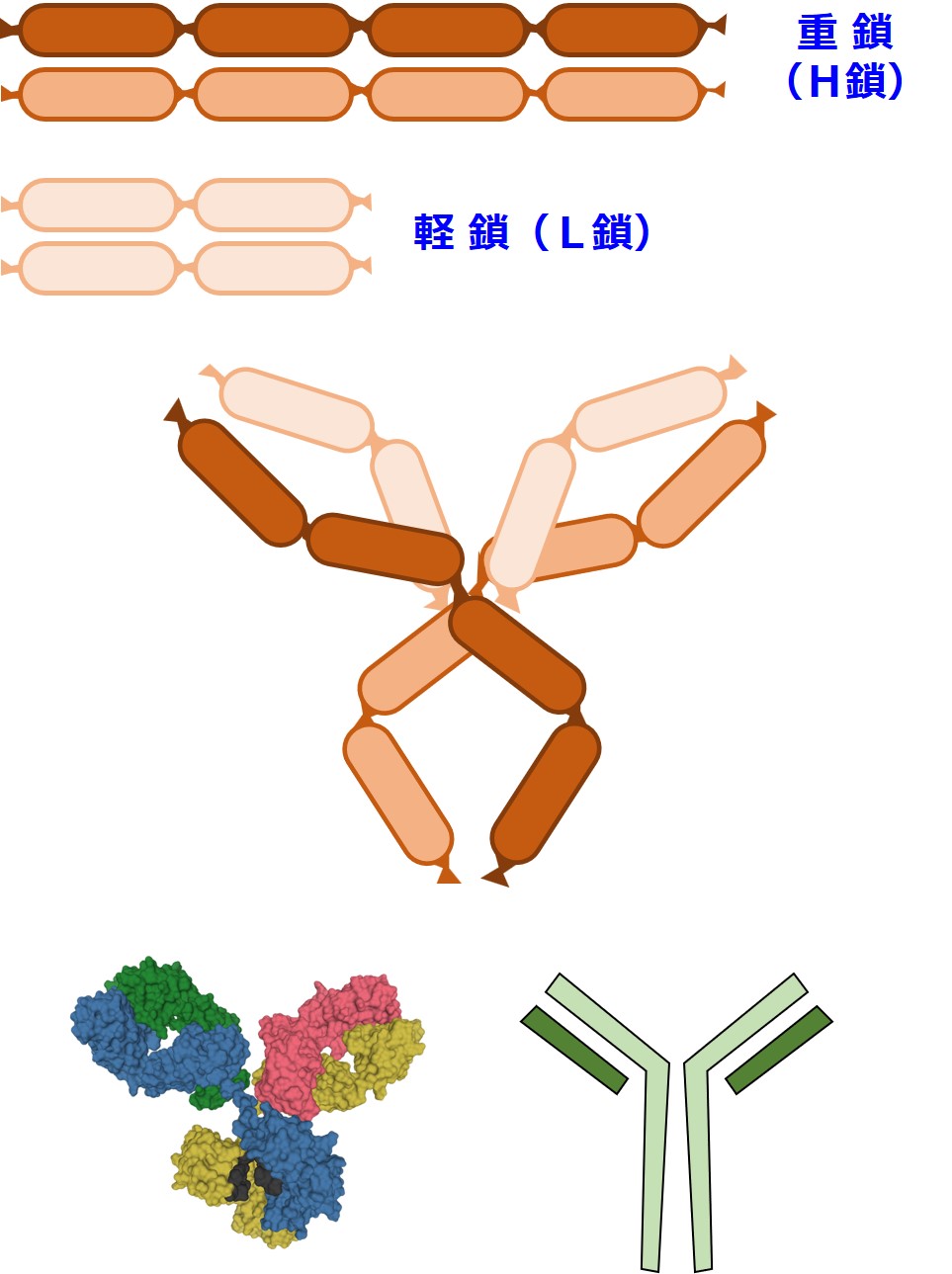
実際の抗体の姿がイメージできるようになれば、もうドメイン(お肉のかたまり)のことは忘れて大丈夫です。
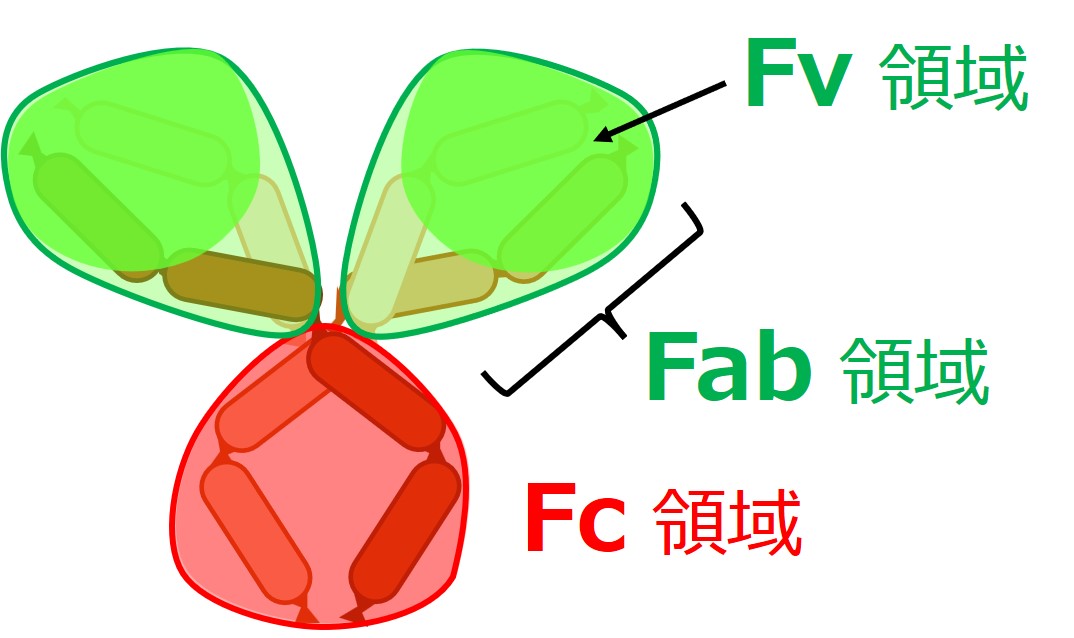
「Y字型」の抗体図はよく用いられますが、なんとなく固い印象を与えてしまいます。実際にはゴーリキーの肩に相当する部分はかなり柔軟に曲がるようです。

「Fab 領域」と「Fc 領域」という区分は、わりとよく使われるので何となく覚えておく価値はあるでしょう。「見たことがあるな」程度でかまいません。
Fab の ab は抗原との結合(antigen binding)の意味です。Fc の c には、特に意味はありません。Fab の次なので Fc となっただけです。Fab 領域のうち、特に多様性の大きい可変部分を Fv 領域と呼ぶこともあります。
いろいろな用語が出てきますが、今後もずっと覚えておいたほうが良いものは特にありません。
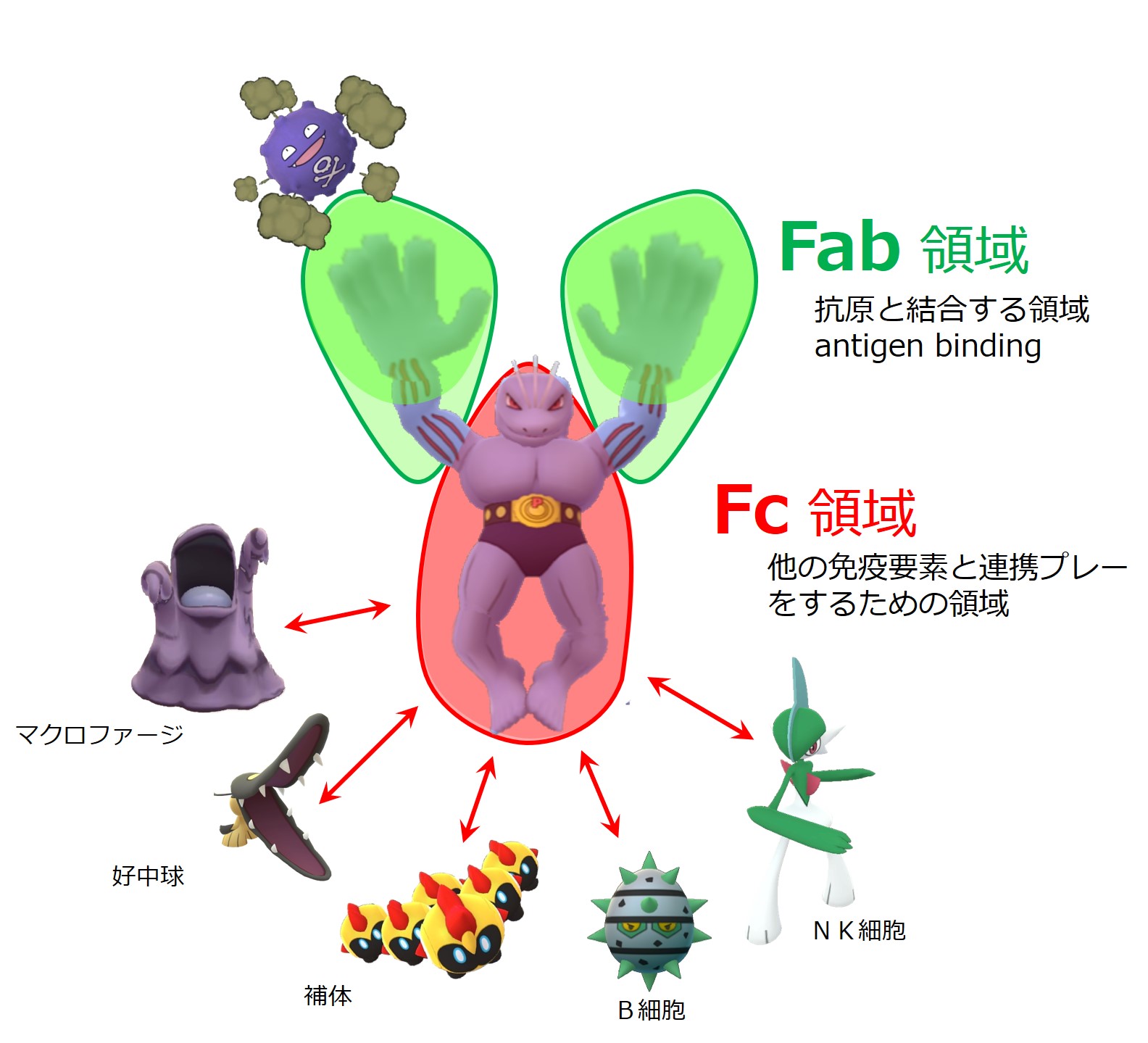
抗体がどんな形をしているのか、その両手でエピトープをつかみ、抗体の体幹と下肢を使って他の免疫細胞と連携するということを理解することが大切です。
抗体の仕事は、何でも手あたり次第に触り、自分の大好きなものを見つけたらガチっとつかむことです。
それだけです。
抗体の大好きなものは、敵です。
しかし抗体は、敵を殴ったりはしません。
抗体がつかんだ敵は、免疫細胞や他の免疫物質がやっつけます。
ある物体に抗体がくっ付くということは、「コイツはコテンパンにやっつけてもいいよ」という許可証を貼り付けることを意味します。
ウイルスなどが抗体を恐れ、抗体に捕まらないように変異(免疫逃避変異)するのは、抗体に捕まると免疫系からの強力な攻撃を受けることになるからです。
何らかの方法で「現在流行中のコロナウイルス SARS-CoV-2」に対して強く結合する中和抗体を用意することは、戦術的には最適の選択肢となります・・・しかし、戦略的には無駄に終わる公算が大きい選択肢となります(・・・免疫学の基礎的な知識だけで、それを理解できるようになります)。
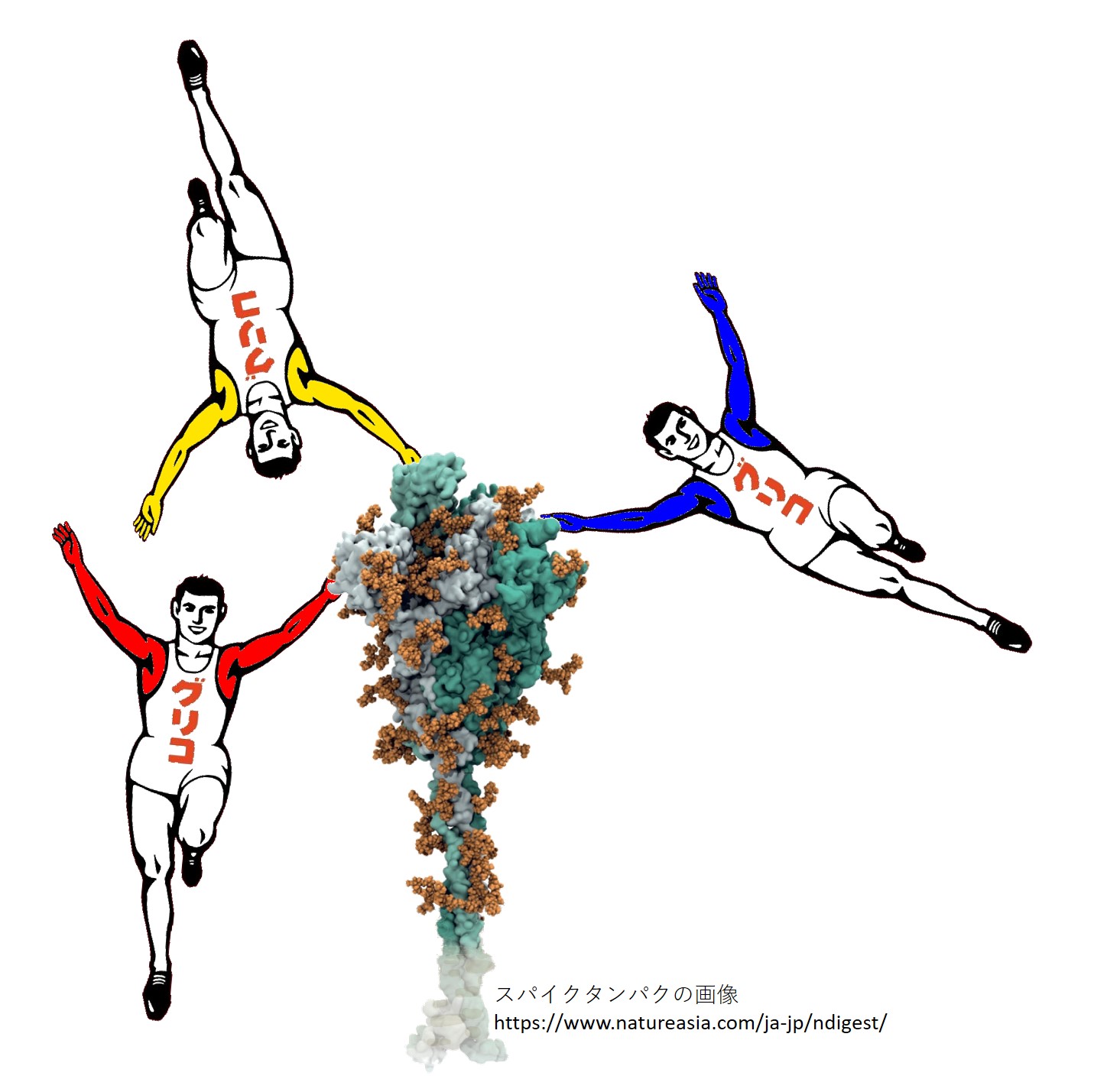
ポケモンの「ゴーリキー」を使うと、抗体が敵をやっつけるんだと勘違いされるので、おもに「グリコの選手」を使うことにします。
でも、手の形はゴーリキーの方が「つかむ(掴む)」感じがあっていいですね。
では、敵のどこをつかむのでしょう。
通常は、5~8個前後のアミノ酸が数珠(じゅず、ブレスレット)のように一列に連なったものをつかみます。
抗体はアミノ酸以外の物質もつかめるのですが、話がややこしくなるので、この手抜き説明では触れません。

生き物の タンパク の基本骨格は、約20種類のアミノ酸がいろいろな順序で一列につながっています。何十個、何百個というアミノ酸が一列に連なっています。
アミノ酸が2個以上つながったものを ペプチド と呼びますが、抗体がつかむのは「アミノ酸5~8個前後の長さを持つ ペプチド」です。

抗体は、あらゆる種類の「アミノ酸5~8個前後のペプチド」をつかむわけではありません。
大雑把な計算ですが、アミノ酸20種類(よく使われるのは19種類)、長さ8個、鎖の左端と右端は区別されると仮定すると、19✕19✕19✕・・・・・=約170億 種類あることになります。長さ7個だと約9億 種類となります。
抗体がつかむのはアミノ酸だけではないので、その候補は1千億 ~ 数千億くらいあるのではないかと試算されているようです(試算方法によっていろいろ)。
しかし、実際にヒトの抗体がつかむのは、数十億 ~ 1千億種類のようです。
抗体がつかむ対象は全候補の十分の一から百分の一くらいに絞られていることになります。
その絞り方の詳細は「3-1-2-5.抗体(2)」で紹介します。ここでは、骨髄における絞り方のひとつを紹介します。
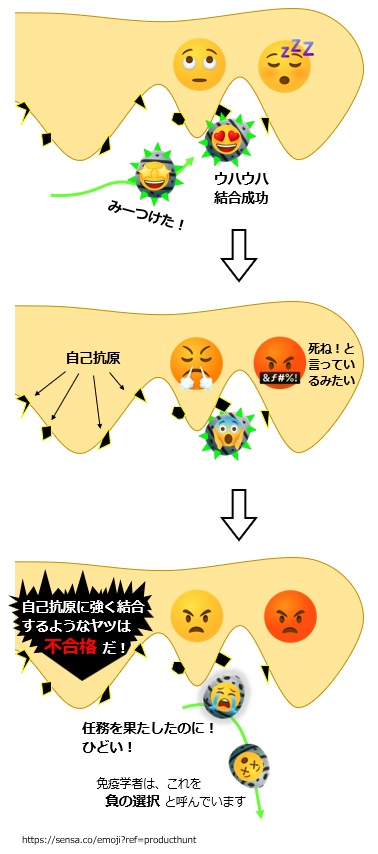
B細胞がその幼少期に教育を受ける学校が 骨髄 にあります。その学校は、仲間殺しの素質を持つ生徒を見つけると、社会に出ないように殺してしまいます。
骨髄の学校には特殊な教師細胞があり、全身のあらゆる自己抗原を細胞表面に出しています。
学校の生徒は、自分の産生する抗体(B細胞受容体)を細胞表面に出し始めた赤ちゃんB細胞です。
試験は簡単です。教師細胞の出している自己抗原に強く結合するかどうかです。
もしヒトの抗体が、ヒトの身体自身が持つ「アミノ酸5~8個前後のペプチド」を強くつかむのであれば、自分の免疫系が自分の身体を攻撃することになります。
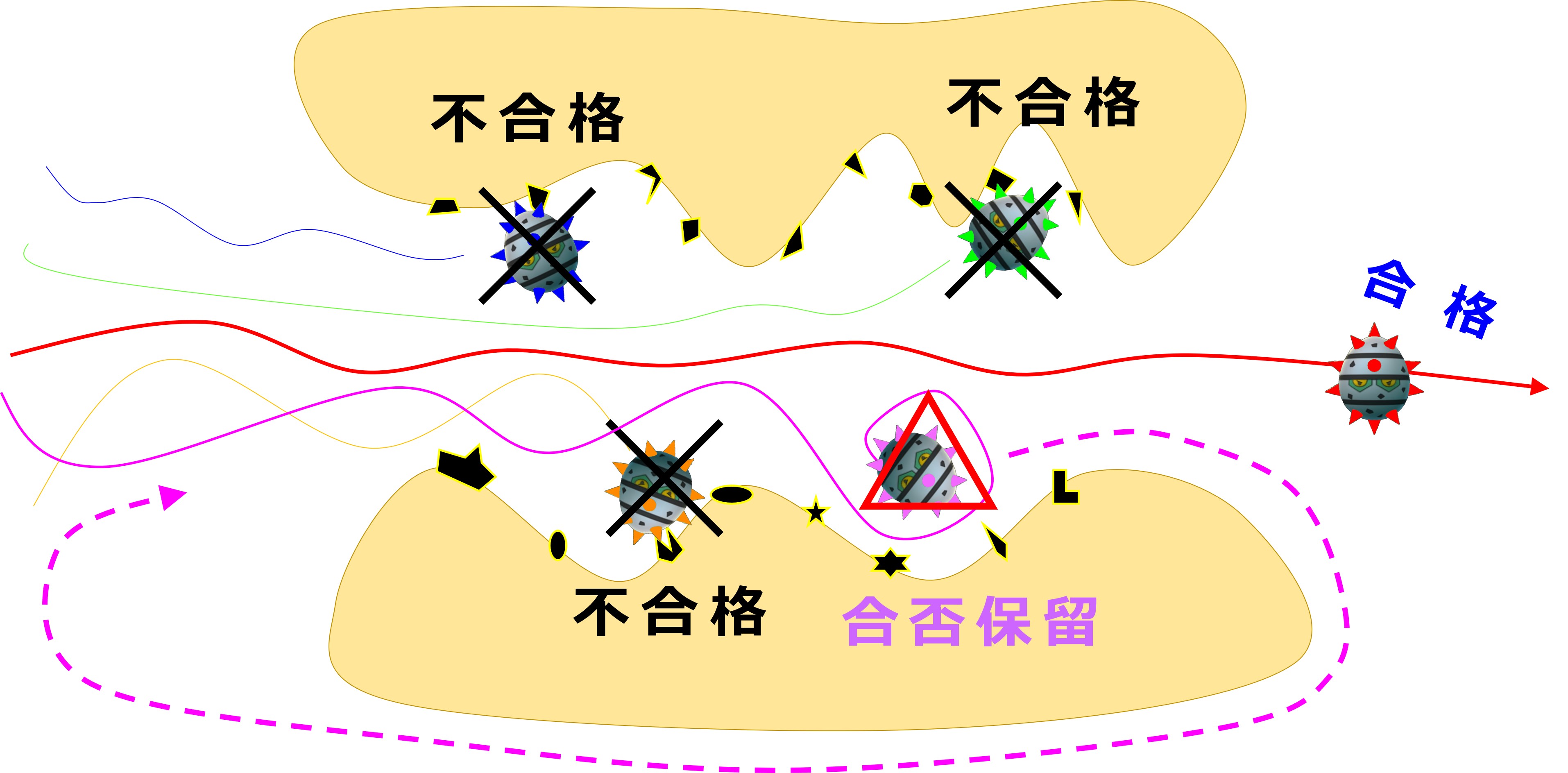
ヒトの免疫系は、そういう抗体(身内を強くつかむ抗体)を作る免疫細胞に対して「お前のやろうとしていることは有害だ。死ね!」と言って殺します。
| B細胞の選別(骨髄) | |
| 自己抗原との結合 | 行き先 |
| +++ | 死 |
| ++ | 受容体編集 |
| + | 生 |
| ー | 生 |
大きく3つのグループに分かれます。
(1) 自己抗原と「ガチっと強く(+++)」結合する抗体を産生するB細胞は自己免疫疾患の原因になりますから、完全に排除されます。
(2) ガッチリではないが、ある程度の強さ(++)で結合する抗体を産生するB細胞は生き残って 受容体編集(receptor editing)へ進み、作る抗体を改良して 再受検 する機会が1度だけもらえます。
B細胞抗原受容体編集(レセプター再編成ともいう)とは、要するに産生する抗体(B細胞受容体)の遺伝子を再構成して、以前とは異なるエピトープに結合できるようにすることです。
(3) 自己抗原に、わずかにタッチするかしない程度の強さ(+ ~ -)で反応する抗体を産生するB細胞は、そのまま抗体産生の下準備のできたB細胞として生き残ります。
抗体産生を担う免疫細胞には、以上のような厳しい教育課程があるので、無事に卒業して戦場に出て行けるB細胞は1割にも満たないそうです。
このようにして抗体がつかむ「アミノ酸5~8個前後のペプチド」は対象が絞られます。
骨髄の学校を卒業できたB細胞の作る抗体は、ヒトの身体にもともとある、つまりヒトの身体を構成するタンパクのアミノ酸配列と「同じ配列・構造を持つアミノ酸5~8個前後のペプチド(自己抗原)」をガチっと強くはつかみません。
自己抗原をまったく無視するか、軽くタッチだけして敵でないことを確認します。グッと強くつかむことはありません。
自己抗原にちょっぴり反応する抗体がある程度許容される理由は、毒作用を持つ物質には、ヒトのタンパクと似た構造を持つものが多いからでしょう。
人の身体内で毒性を発揮する(つまり生理的活性を持つ)タンパクは、ヒトのタンパクと似たようなアミノ酸配列の部分を持っています。似ているからこそ、ヒトのホルモン等の受容体にくっついて、活性(この場合は、毒性)を示すのです。
ヒトの自己抗原にある程度の強さで結合する抗体は、こうした毒物質に結合してその毒作用を消す(中和する)可能性を持っていますから、そういう抗体を産生するB細胞は生き残ります。
しかし、自己抗原と「ガチっと強く結合するか」、「ある程度強く結合するか」、その境界はあいまいです(・・・なので、自己免疫反応を完全に排除することは原理的に不可能です)。
抗体がつかむ「敵固有のアミノ酸5~8個前後のペプチド」のことを「エピトープ」と呼びます。
エピトープ は、ふだん 抗原 と呼んでいるものの最小単位です。
エピトープ(抗原決定基)には、アミノ酸以外のものも含まれていますが、この手抜き説明ではアミノ酸に絞って説明していきます。
ヒトがもともと持っているタンパクを特に 自己抗原 と呼ぶことがあります。病的理由などがあると自己抗原をガチっとつかむ抗体が作られます。そういう抗体を 自己抗体 といいます。自己を敵として認識し、強く反応する抗体という意味です。
次図(↓:上・中・下)は、骨髄での厳しい教育課程を卒業した抗体の性能を示しています。
敵(=非自己)のエピトープ[上]を見つけるとガチっとつかみます。
それとよく似た変異エピトープ[中]は、ガチっよりはゆるくつかみます。よく似ているほど強くつかみます(交差免疫)。
自己抗原[下]には軽くタッチすることはありますが、つかみません。
もちろん、境界はあいまいです。

抗体と抗原の結合の強さは、主に電気のプラス・マイナスの引力や斥力で決まっています。分子の表面にはプラス・マイナスの電荷分布があります。抗体の手の部分の電荷分布とエピトープ表面の電荷分布がうまく合うと、ガチっと結合することになります。
新型コロナウイルスが細胞侵入時に使う スパイクタンパク は、約1300個のアミノ酸が連なり、それに糖鎖がいっぱいくっついてできています(分子量は約18万~20万)。「3-2-2.コロナのスパイク」でも紹介します。
同じ3個のスパイクタンパクが組み合わさってひと塊(三量体)の突起を形作っています(下の図では緑色の濃さで塗り分けられています)。
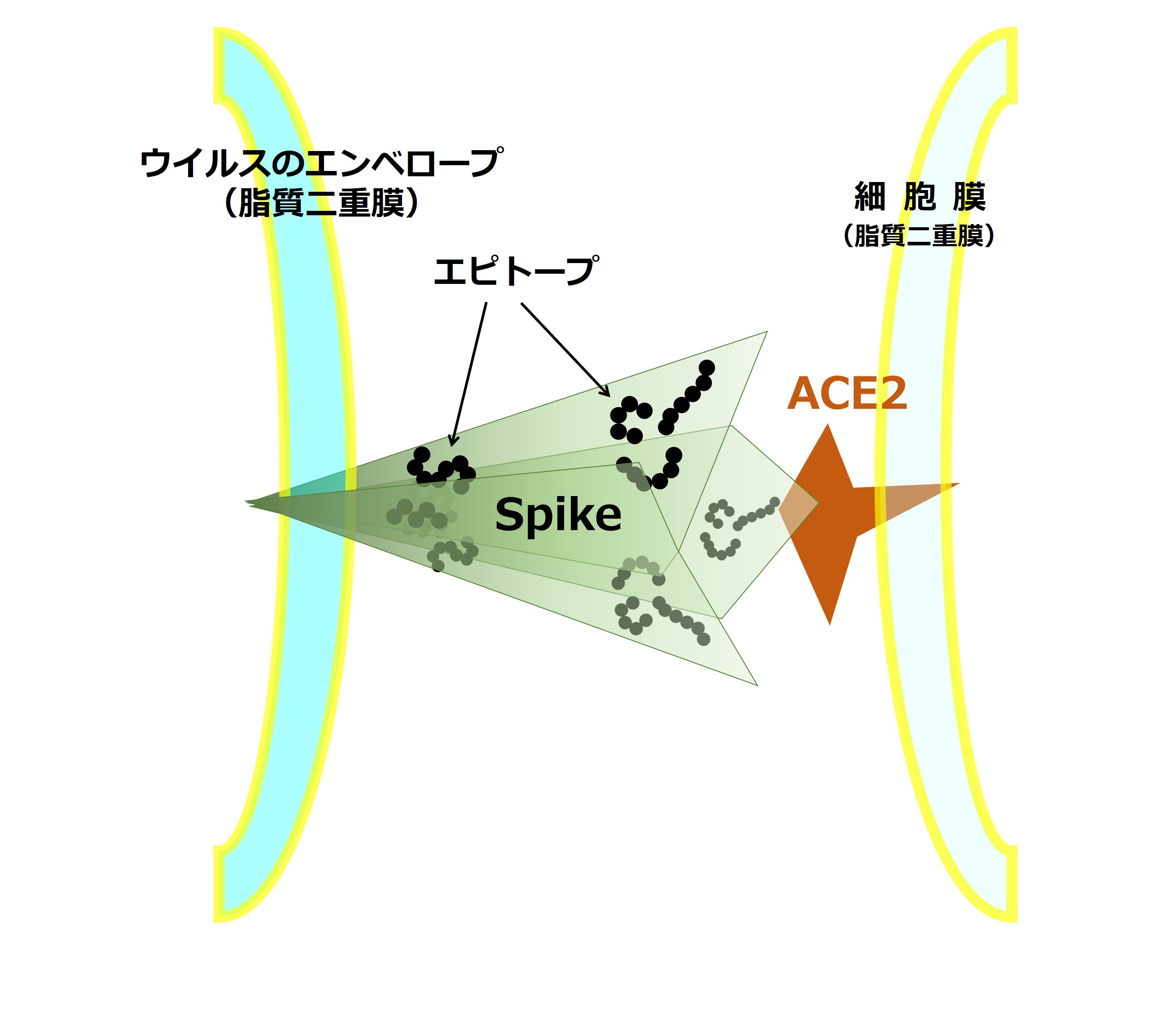
長い長いアミノ酸の鎖の所々に、抗体のつかむエピトープが存在します。
代表的抗体であるIgG(免疫グロブリンG)も、約1300個のアミノ酸が連なっています(分子量は約15万~)。
体格的には、ほぼ互角ですね。
スパイクタンパクの表面に出ている数種類のエピトープを抗体がガチっとつかむと、こんな感じになります(下図↓、茶色は糖鎖です)。
スパイクタンパク画像の出典:Nature ダイジェスト(Vol.18 No.10)「新型コロナウイルスが細胞に侵入する仕組み」ここで読む必要はありません。「3-2-2.コロナのスパイク」でも紹介します。
Nature ダイジェストに興味深い記述があります。
***********************************
このコロナウイルスは、豪奢(ごうしゃ)な糖の衣をまとっている。重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)のトレードマークであるスパイクタンパク質の1つをコンピューター・シミュレーションで見たRommie Amaroは、目を見張った。ウイルスの表面から突き出すスパイクタンパク質には、糖鎖(とうさ)がびっしりと巻き付いていたのである。
カリフォルニア大学サンディエゴ校(米国)の計算生物物理化学者であるAmaroは、「これだけの糖鎖で覆われていたら、(抗体はコレを)ほとんど認識できません」と言う。
実際、外側のタンパク質を糖鎖で覆い、羊の皮をかぶった狼のように私たちの免疫系の監視の目を欺いているウイルスは多い。
***********************************
先ほどの図は修正しないといけませんね。
抗体は、糖鎖に覆われていないエピトープだけを、ガチっとつかめるのです。

これは、コロナ感染で抗体がわりと役に立たない原因のひとつでしょう。
しかし、この手抜き解説ではこのことを深く追求しません。
ある病原体(P)に対してできた獲得免疫が異種の病原体(Q)に対してもある程度有効に働くことを 交差免疫 といいます。
液性免疫(抗体)の面では、交差免疫がおこる機序として2つ考えられます。
抗体側とエピトープ側の電荷分布を1次元で表すと、交差免疫(機序1)は次図のようになります。
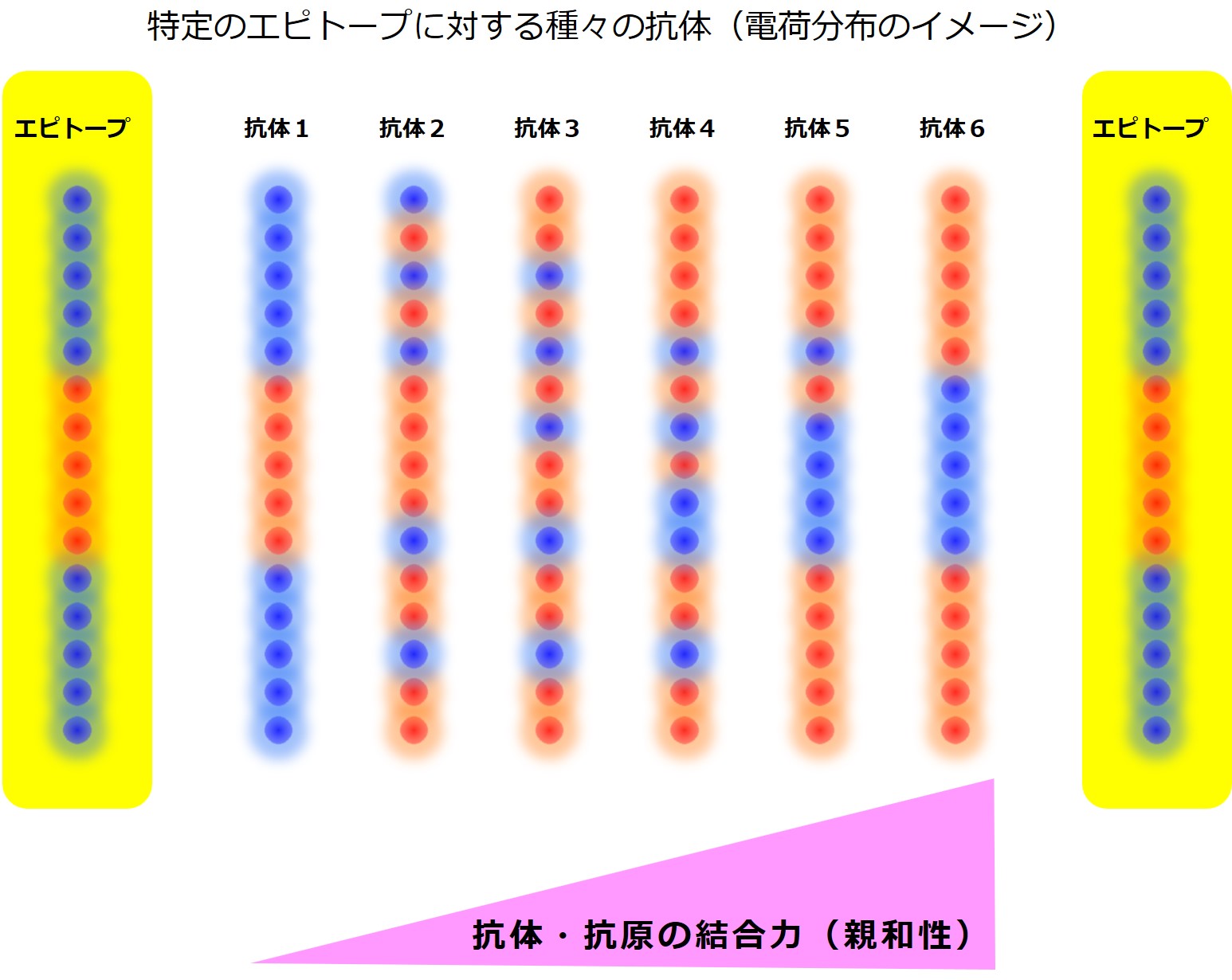
このエピトープにガッチリと強く結合するのは「抗体6」であり、まったく結合しないのは「抗体1」です。
その間にある抗体はこのエピトープにゆるく弱く結合するわけですが、「抗体5」や「抗体4」は比較的強く結合するでしょう。
病原体Pの抗原と病原体Qの抗原の複数個のエピトープで交差免疫(機序2)を描くと次図のようになります。
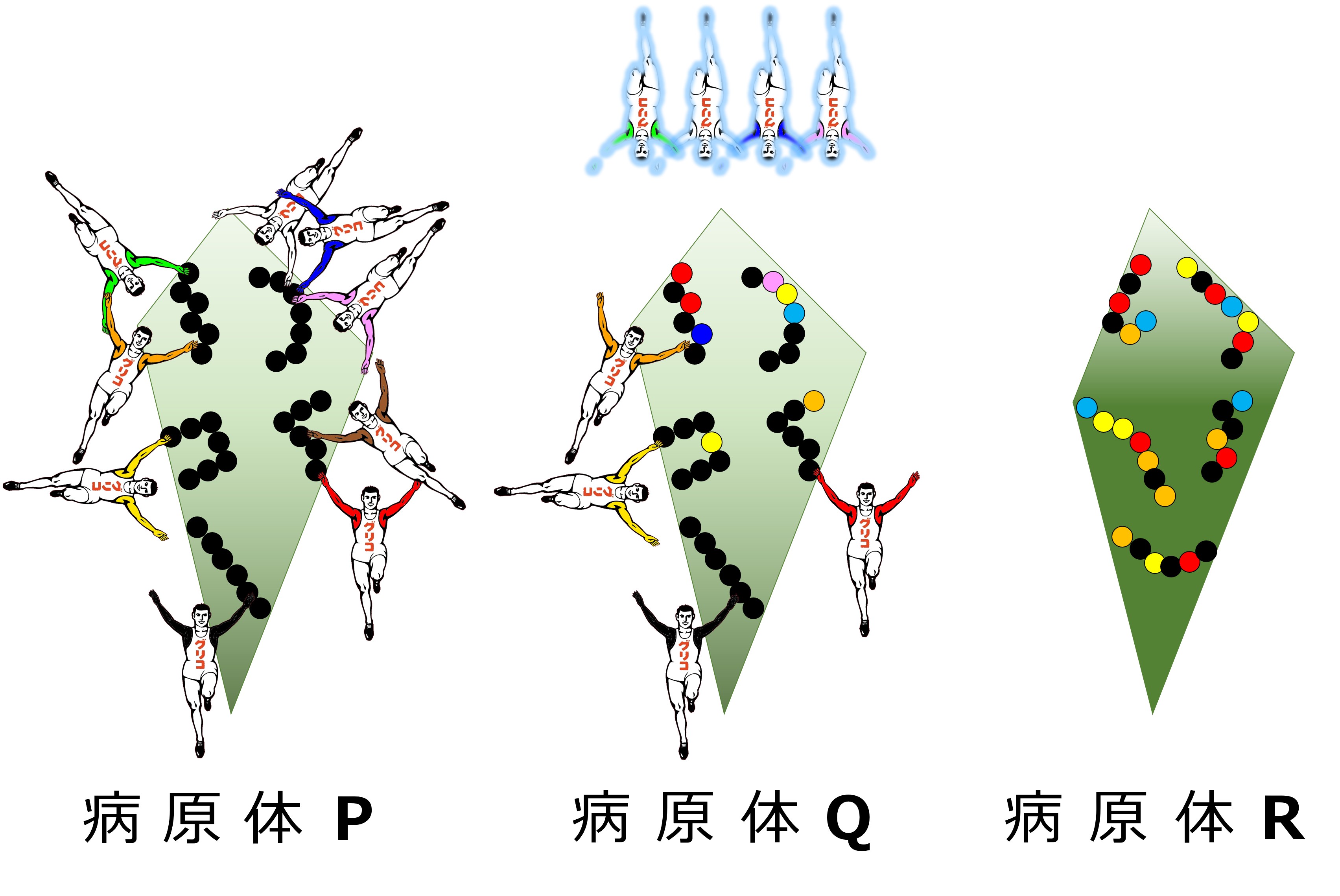
病原体Pのエピトープに対して作られた抗体群の一部が、病原体Qの一部のエピトープに結合します。
病原体Rには共通エピトープや類似エピトープが無いので、病原体Pのエピトープに対して作られた抗体はどれも結合しません。
抗体には、いろいろな種類があります。
大きく5つのクラスに分類されています:IgM、IgA、IgG、IgE、IgD
「Ig」は Immunogloblin (免疫グロブリン)の略です。
コロナ感染に関係する抗体として知っておくと良いのは IgM、IgA、IgG の3クラスです。
IgG のサブクラスには、 IgG1、IgG2、IgG3、IgG4 の4種類あります。
免疫学の基礎レベルだと、IgGの種類まで知る必要はないのですが、mRNAワクチン接種(初期型)を繰り返し接種する時の副作用として「IgG4」の増加による免疫抑制の可能性が知られていますので、このウェブサイトでは説明しておきます。
クラスの構造的な違いは何かというと、抗体の胴体から足元にかけての部分(Fc領域)が異なっています。
では、抗体の種類と働きの違い等について簡単に紹介します。
覚える必要は特にありません。たくさん目にする機会があれば、勝手に覚えるでしょう。
| クラス | IgM | IgA | IgG |
| H鎖 | μ:ミュー | α:アルファ | γ:ガンマ |
| 単量体 |  |
 |
 |
| 分泌型 | 5量体 |
2量体~4量体   |
ー |
| 特徴 | 幼若なB細胞の表面に出ている(単量体) | IgM産生 → IgA産生 へクラススイッチされる | IgM産生 → IgG産生 へクラススイッチされる |
| 感染時、最初に分泌される 抗原との結合力は弱い |
IgA産生B細胞は、リンパ節から粘膜下へ移動し抗体を産生 | 親和性成熟により変化する(対応するエピトープとの結合力が強くなったり、多様な類似エピトープに結合できるようになったりする) | |
|
IgA抗体は粘膜上皮細胞に取り込まれ、粘液と共に分泌される |
|
NK細胞(ナチュラルキラー)は、キラーT細胞に似た自然免疫系の殺し屋です
IgA や IgM は、エピトープと少し緩めに結合し、IgGは(親和性成熟で結合力の調整を受けるため)対応エピトープにわりとガッチリと結合します。
つまり、敵である病原体の侵入に対して「緊急出動」する必要があるため、少し結合が弱くても良いから取り急ぎ作れということで IgM の産生は始まるのでしょう。
IgA や IgM は、複数の抗体同士がFc領域(抗体の胴体~足元)を結合させて多量体の形で働きます。
抗体の結合により病原体同士が絡み合い、感染力を弱める効果が期待できます。
しかし、抗体のFc領域(足元部分)は、各種免疫細胞との連携に使われる部分です。多量体形成は、他の免疫細胞との連携に期待せず、抗体だけで頑張るということも意味しているのでしょう。
取り急ぎ産生された IgM が頑張っている間に、リンパ節では親和性成熟と クラススイッチ が進みます。エピトープとガッチリと結合する抗体を産生するB細胞が選抜され、IgM 産生 → IgG 産生へと変化していきます。
IgG は、IgMよりも抗原とガッチリと結合することで「敵を証明する能力、言い換えると自己抗原ではないことを保証する能力」が優れています。
そのため免疫系は IgG の結合した抗原に対しては強力な攻撃を加えます。
IgGは、自然免疫系の免疫細胞と連携し、オプソニン化(食細胞は抗体の結合した抗原に対する食欲が増す)や ADCC(NK細胞は抗体の結合した感染細胞を殺す)で病原体や感染細胞に強力な攻撃を加えます。
このような他種細胞等との連携が前提なので、IgG は多量体を形成しません。多量体を形成するとFc領域(抗体の胴体~足元)の利用が制約されます。
獲得免疫系の攻撃力は強大なので、立ち上がりと同時に、免疫系の過剰攻撃を防ぐ仕組みも動き始めます。
それを担当するのが「IgG4 産生のB細胞」です。表では、B細胞に対する抑制(IgG4)と書かれています。
| サブクラス | IgG1 | IgG2 | IgG3 | IgG4 |
| H鎖 | γ1 | γ2 | γ3 | γ4 |
| 単量体 |  |
 |
 |
 |
| 特徴 |
|
|
||
ここでは、抗体にはいろいろと種類があるんだなぁ・・・程度のことを知るだけでかまいません。
「3-4.コロナに対する免疫」や「3-5.感染例からコロナの免疫を知る」などで、コロナ感染に対しては抗体が意外と役立たずであることを知ることになります。
参考:免疫グロブリンについて (日本血液製剤協会)
参考:抗体について 5種類のタイプ (協和キリン)
参考:IgG2、IgG3測定の意義 (野々山恵章;ののやましげあき)
次の「3-1-2-4.親和性成熟とクラススイッチ」、「3-1-2-5.抗体(2)」は、先に「3-1-3.抗原提示」と「3-1-4.T細胞受容体」が終えてから読む方がわかりやすいでしょう。