接種時期選定の参考 (新)


◆ TCR(T-cell receptor)
◆ 胸腺におけるT細胞教育:工事予定
◆ 総復習:ウイルスに対する免疫応答の仕組み
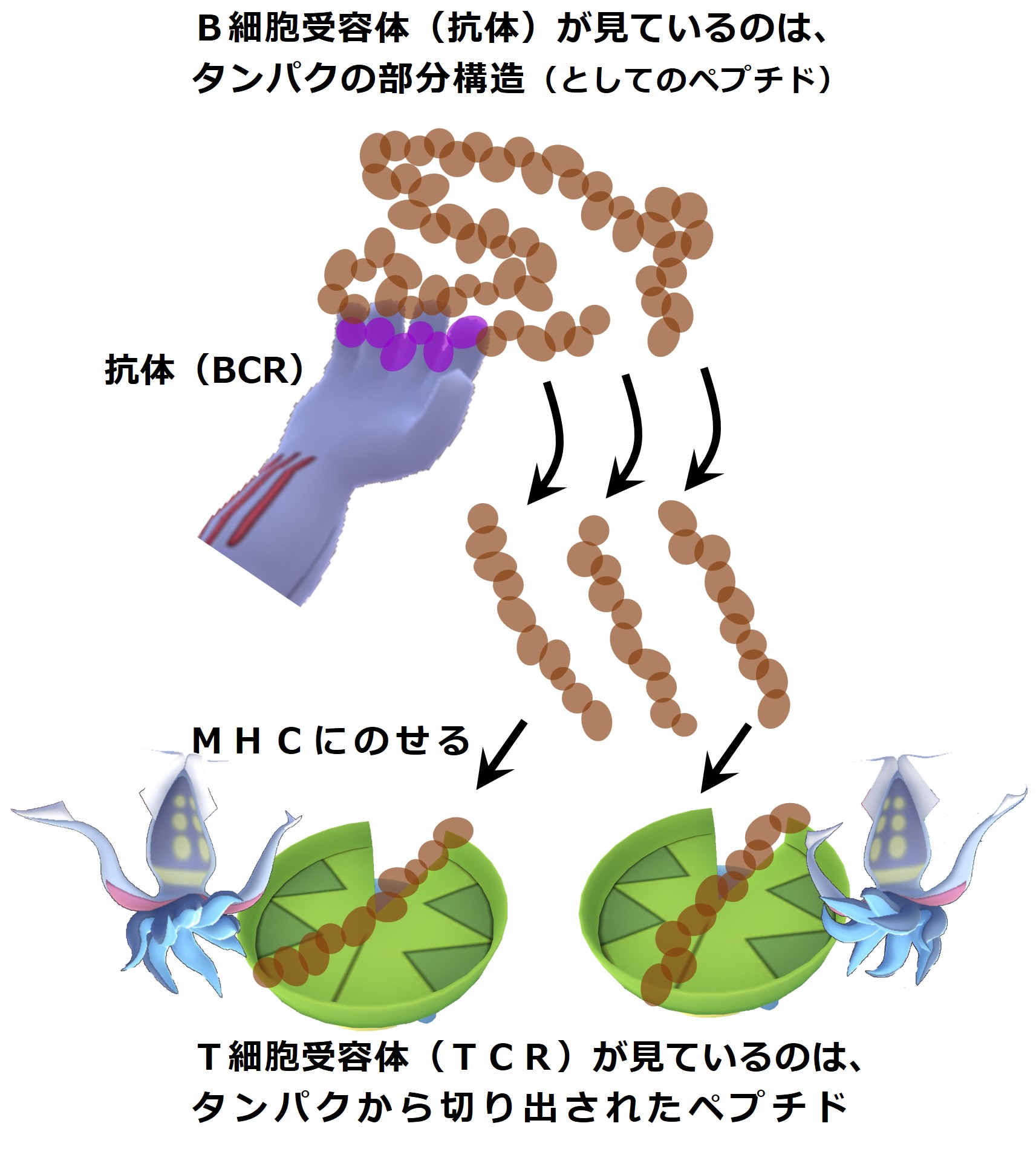
リンパ球のB細胞にあるB細胞受容体(BCR≒ 抗体)に相当するものがT細胞にもあります。
それがT細胞受容体(TCR)です。
作られ方も似ていて、大きさ(分子量)も抗体と似たようなものです。
抗体はペプチド抗原を識別して結合しますが、T細胞受容体は「MHC+ペプチド抗原」を認識して結合します。
仕事の中身も似ているわけです。
次図は、TCR(T細胞受容体)が「MHC+ペプチド抗原」と結合した時の様子です。

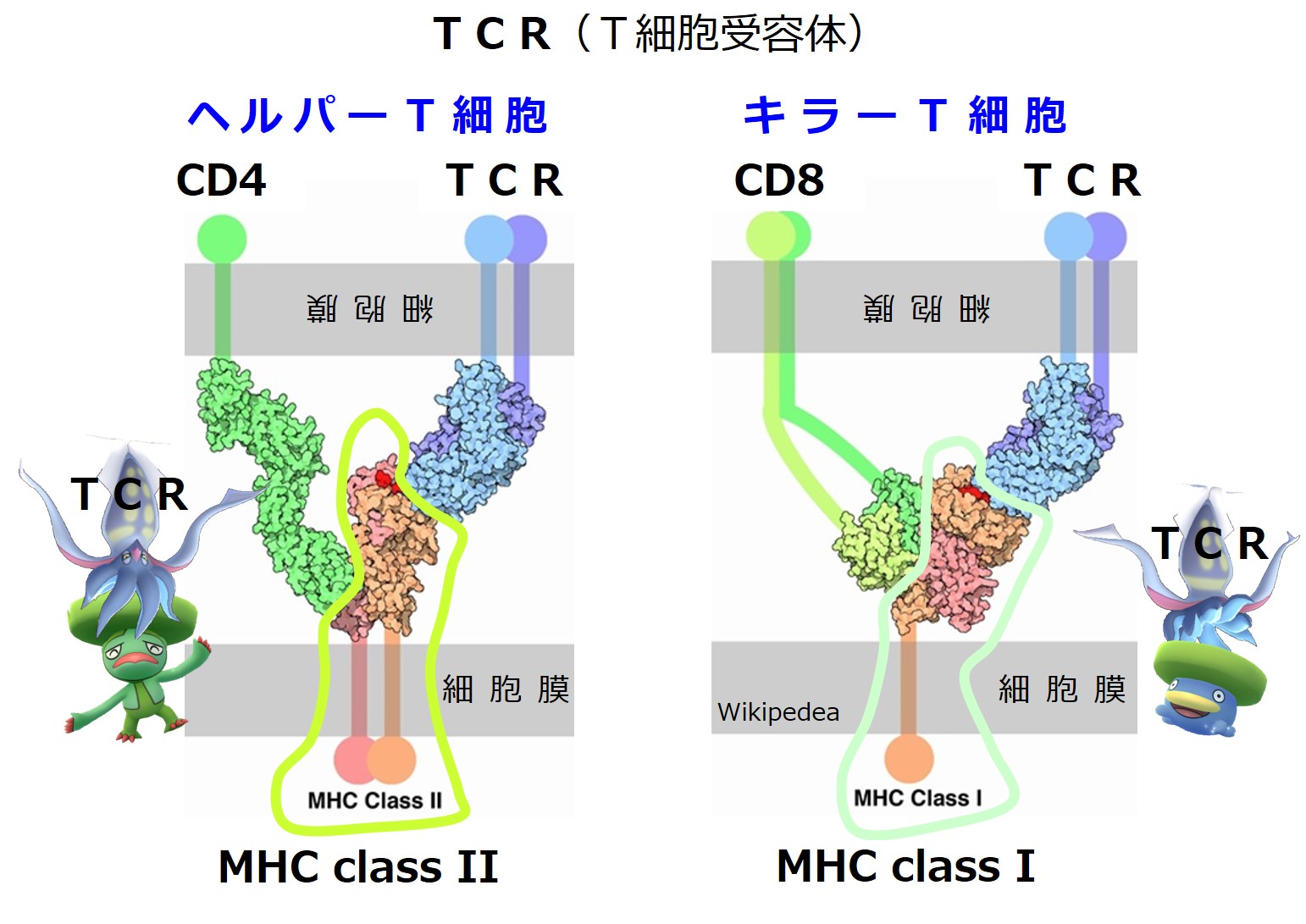
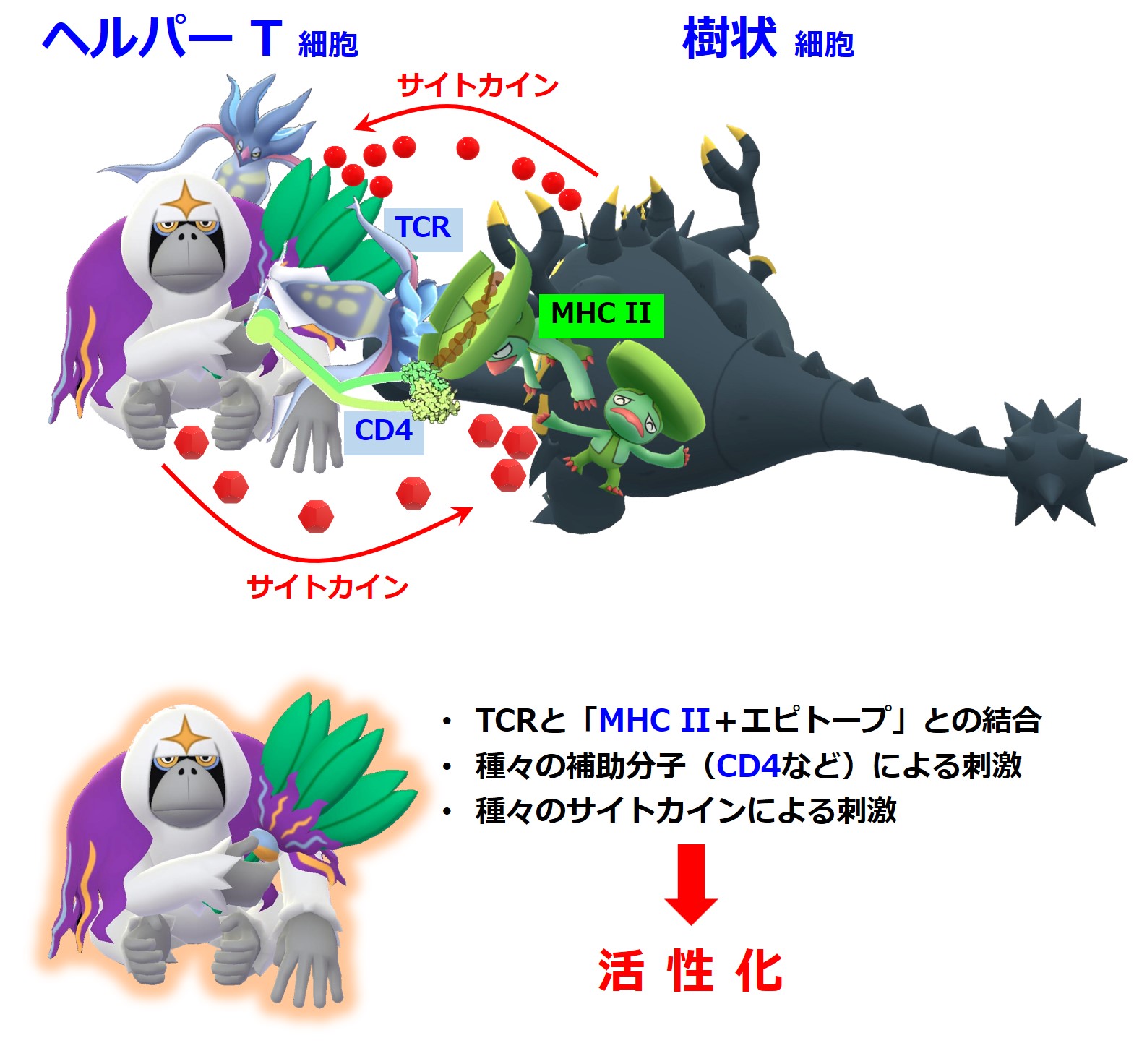
上図の「CD4」や「CD8」は補助分子です。
T細胞受容体と「MHC+ペプチド抗原」との間では、抗原特異性の確認に全神経を集中しています。
T細胞が担当している抗原に間違いないことが確認できた時の色々なやりとりは種々の補助分子やサイトカインが担当します。
サイトカインとは、細胞から分泌され、他の細胞とのコミュニケーションに使われる化学物質(小さなタンパク)の総称です。わりと聞く機会の多いインターフェロンやインターロイキンもサイトカインの一種です。
抗原特異性の表を発展させましょう。
| 抗原のチェック | MHC+抗原 | ペプチド抗原の長さ | 抗原提示の受け手 |
| 食細胞 → ヘルパーT細胞 | class II+抗原 | 10 ~ 30 個 | TCR(+CD4) |
| 食細胞 → キラーT細胞 | class I+抗原 | 8 ~ 11 個 | TCR(+CD8) |
| すべての体細胞 → キラーT細胞 | class I+抗原 | 8 ~ 11 個 | TCR(+CD8) |
| 抗原 → B細胞受容体との結合 | 抗原 | 5 ~ 8 個 | 抗体 |
このページでは、獲得免疫の抗原特異性を担保している分子は、「MHC」、「TCR」、「抗体」の3つである ことを覚えてください。
ここで、抗原特異性の表の持つ意味を紹介しておきます。
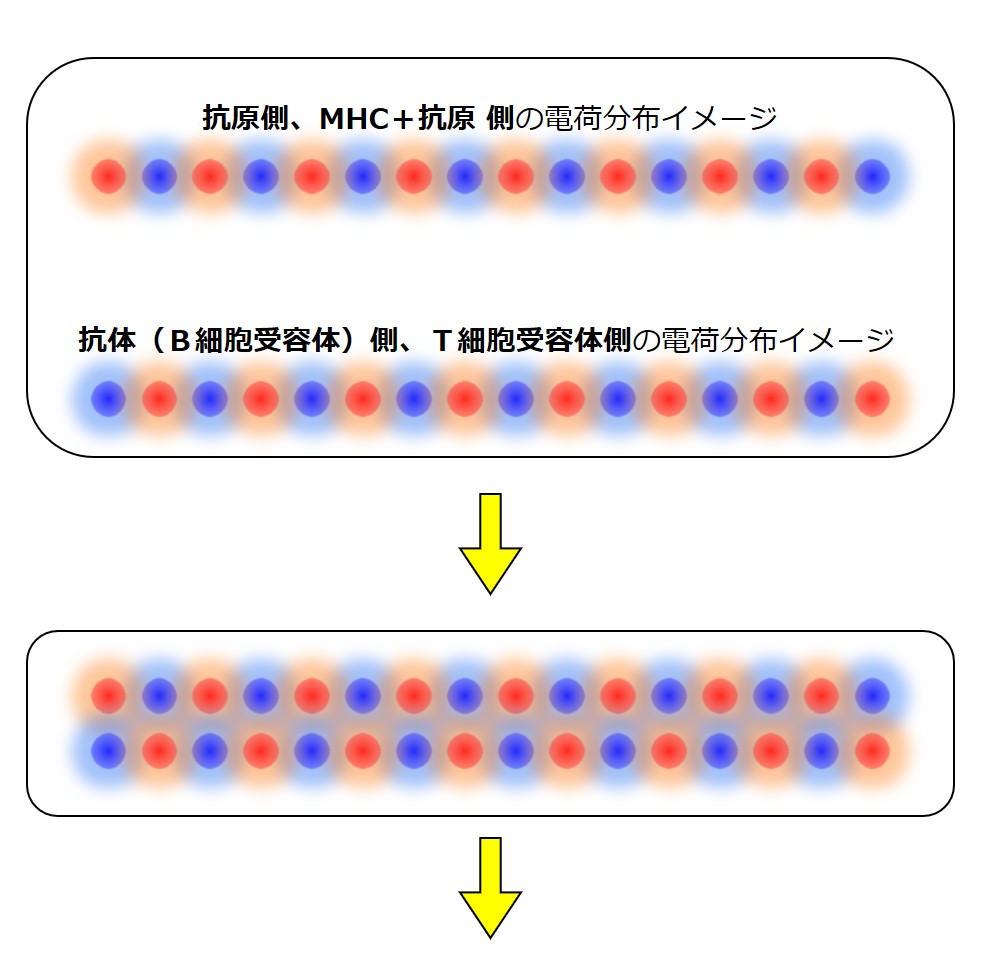
あくまでイメージ的説明ですが、ペプチド抗原の電荷分布を次図のように超単純化して1列で表してみます。
「+」と「-」の異極同士は引き合い、「+」と「+」また「-」と「ー」の同極同士は反発します。
最初は相性がよく、ピッタリくっ付き合っていたとします。
そして(遺伝子変異などによる)アミノ酸の入れ替わりで「抗原側」の電荷分布も変化する様子を次図のようにイメージします。
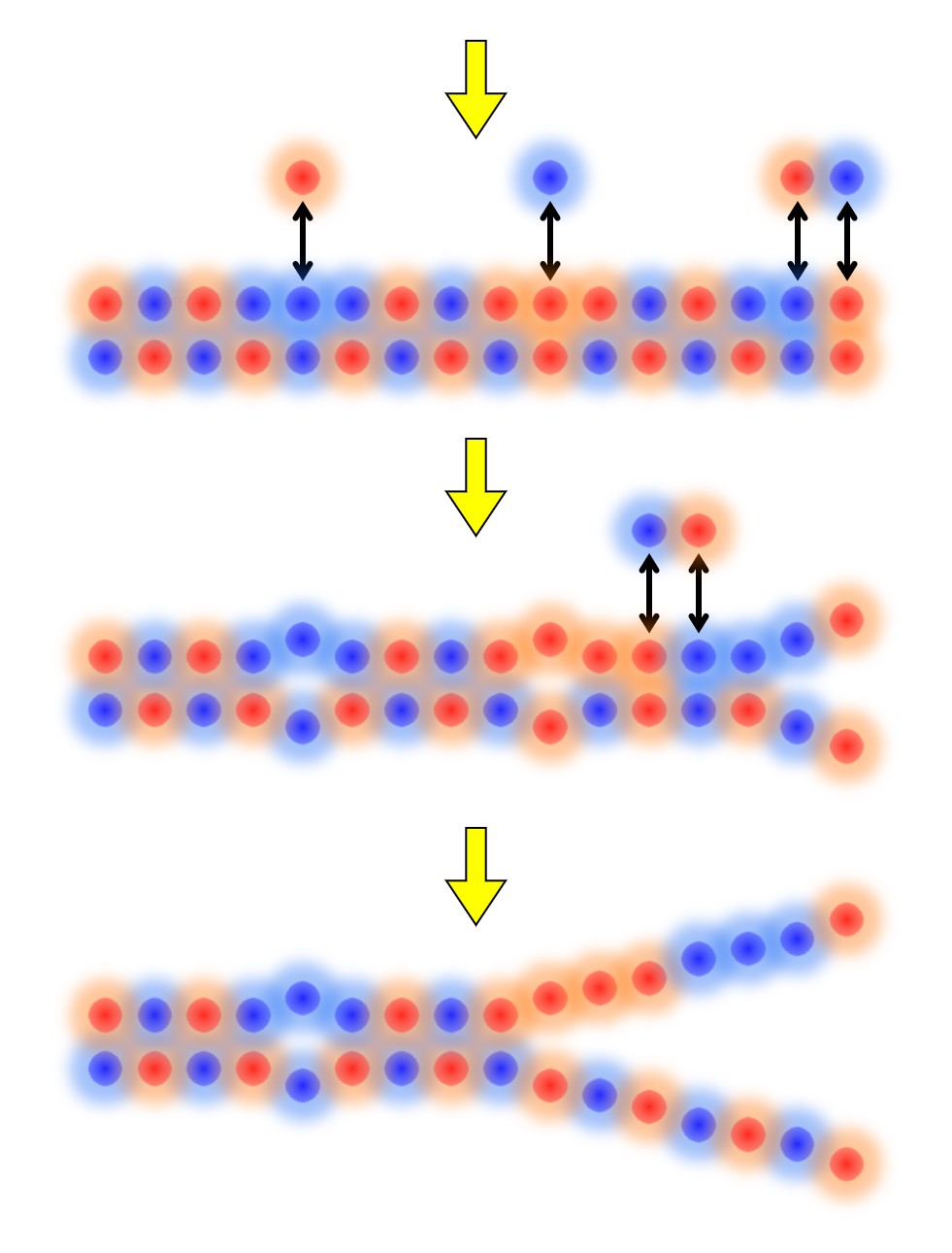
最初はとても気の合った恋人が、ちょっとしたすれ違いが重なって別れていく様子と似ていますね。
でも、ここで言いたいのはそういうことではありません。
次図を見てください。
「変異の起こる確率による影響」はペプチド抗原の配列が長くても短くても同じですが、「変異の個数」による影響はペプチド抗原の配列の短い方が大きいのです。
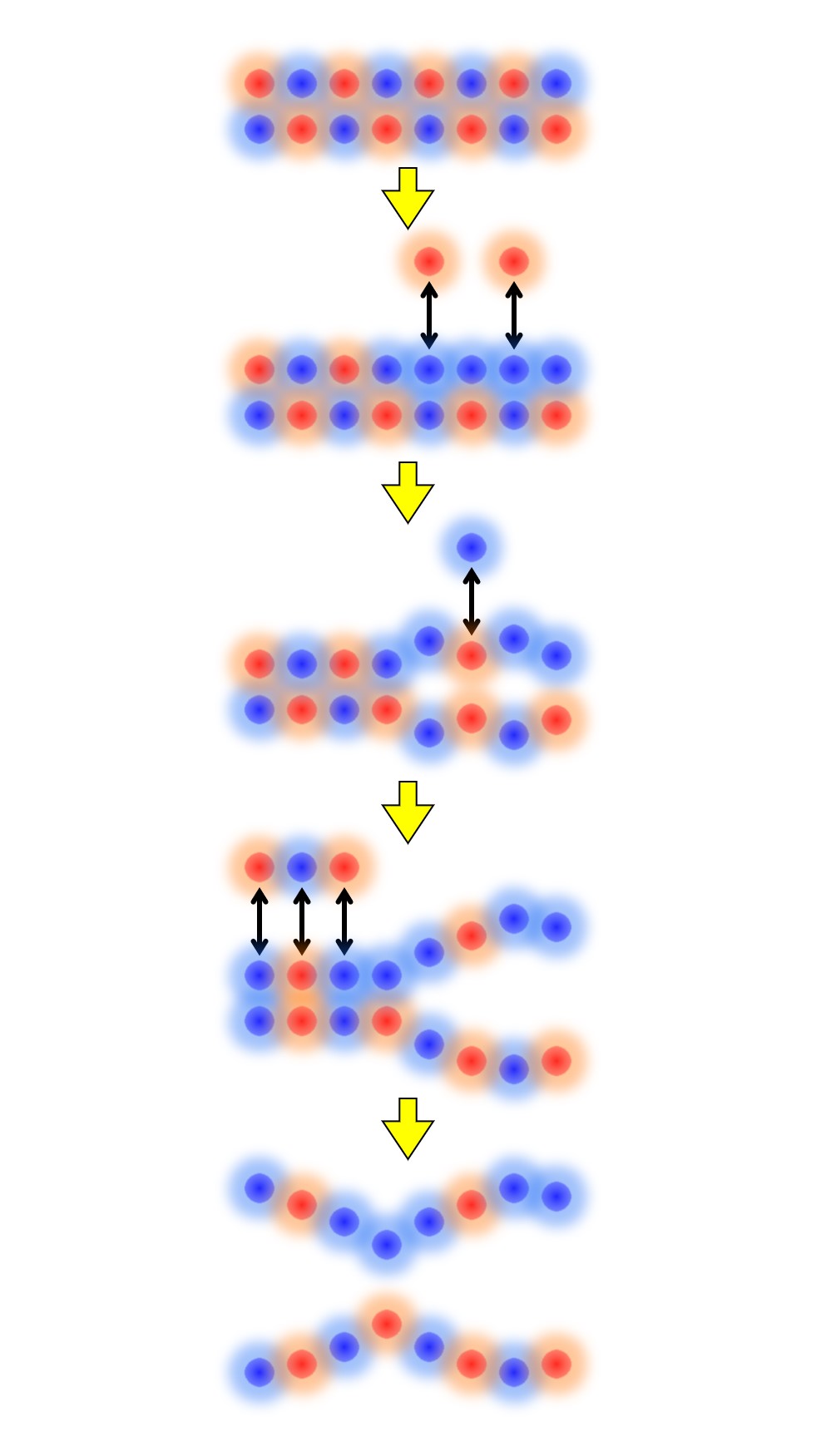
つまり、液性免疫の「ペプチド抗原と抗体との結合」は、細胞性免疫の「ペプチド抗原/MHCとTCRとの結合」よりも変異の影響を受けやすいのです。
抗体の場合は、「抗原の長さの問題」に「立体構造の問題」が加わります。
B細胞の作る抗体が結合するエピトープは、タンパクの大きな構造の中に組み込まれています。
液性免疫のエピトープは、タンパクの一部として、折れ曲がったり、ねじれたり、様々な立体構造をとっています。
折れ曲がったエピトープが真っすぐになるだけで、それまで結合できていた抗体が結合できなくなる可能性があります。
抗体は、別にアミノ酸の配列を見ているわけではないからです。
エピトープのアミノ酸配列を見ているのは「科学者の脳」です。
抗体が見ているのは電荷分布です。
アミノ酸配列が同じでも、折れ曲がったものが真っすぐになれば、電荷分布としては別物なのです。
TCRに比べると、抗体の認識はかなりデリケート(繊細、ち密)です。
そのぶん、免疫系は抗体に対して高い信頼を置いているようです。
抗体が認識する敵に対しては、強烈で執拗な攻撃を行うようです(個人的感想です)。
逆の見方をすれば、液性免疫はペプチド抗原の立体構造を含めて見ているので敵味方の識別に必要なアミノ酸数が5~8個と、TCRに比べて少なくなっているのでしょう。
ヘルパーT細胞のTCR(T細胞受容体)と樹状細胞が提示する「MHC class II + エピトープ」とが、しっかりと結合さえすればヘルパーT細胞が活性化するわけではありません。
CD4などの補助分子による刺激や各種のサイトカインが働いて初めてヘルパーT細胞は活性化します。
キラーT細胞もTCRと樹状細胞の「MHC class I + エピトープ」との結合だけで活性化するわけではありません。
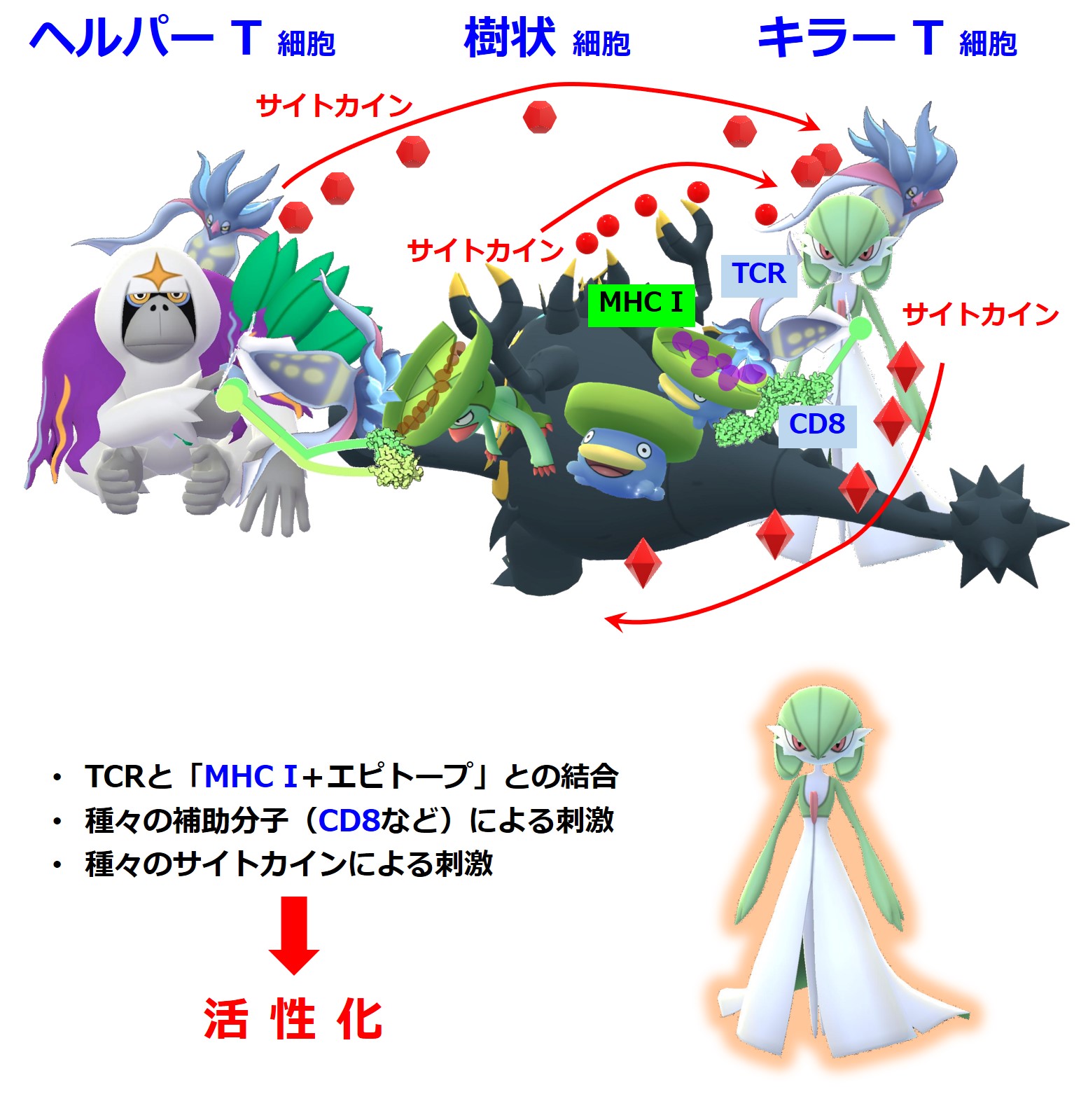
この補助分子の名前を使ってT細胞を呼ぶことがあります。
「ヘルパーT細胞」は「CD4陽性細胞」、「CD4+細胞」、「CD4+T細胞」と記載されたり、「Th」と略記されたりします。
「キラーT細胞」は、「CD8陽性細胞」、「CD8+細胞」、「CD8+T細胞」、「細胞障害性T細胞( cytotoxic T cell)」と記載されたり、「Tc」、「CTL」と略記されたりします。
覚える必要はありません。将来、そういう表記と出会った時に、難しいと感じないように紹介しているだけです。
「MHCクラスI」はすべての体細胞が持っています。
もしサイトカインや補助分子による十分な刺激を受けることができる局所環境であれば、感染した細胞が提示する「MHC class I + 病原体のエピトープ」との結合でキラーT細胞は活性化できます(・・・が、リンパ節内での活性化よりも効率は悪いような気がします)。
このウェブサイト「接種時期選定の参考」では、種々のワクチンのメリット・デメリットを考えるうえで役立つ最低限の免疫学的知識を習得目標としています。
補助分子やサイトカインの詳細を覚える必要がありません。そういうものがあるんだ程度でよいでしょう。
「細胞性免疫」は「液性免疫(主役は抗体)」よりもウイルスの変異に強い理由をここで簡単に説明しておきます。
抗体はエピトープに結合します。エピトープはタンパクの場合、5~8個のアミノ酸が連なった短いペプチド(小さなタンパク)です。その5~8個のうち、1個が似たような電気的構造を持つアミノ酸に入れ替わっても抗体は結合できるかもしれませんが、そうでないときは1個のアミノ酸の入れ替えだけで結合できなくなる可能性があります。
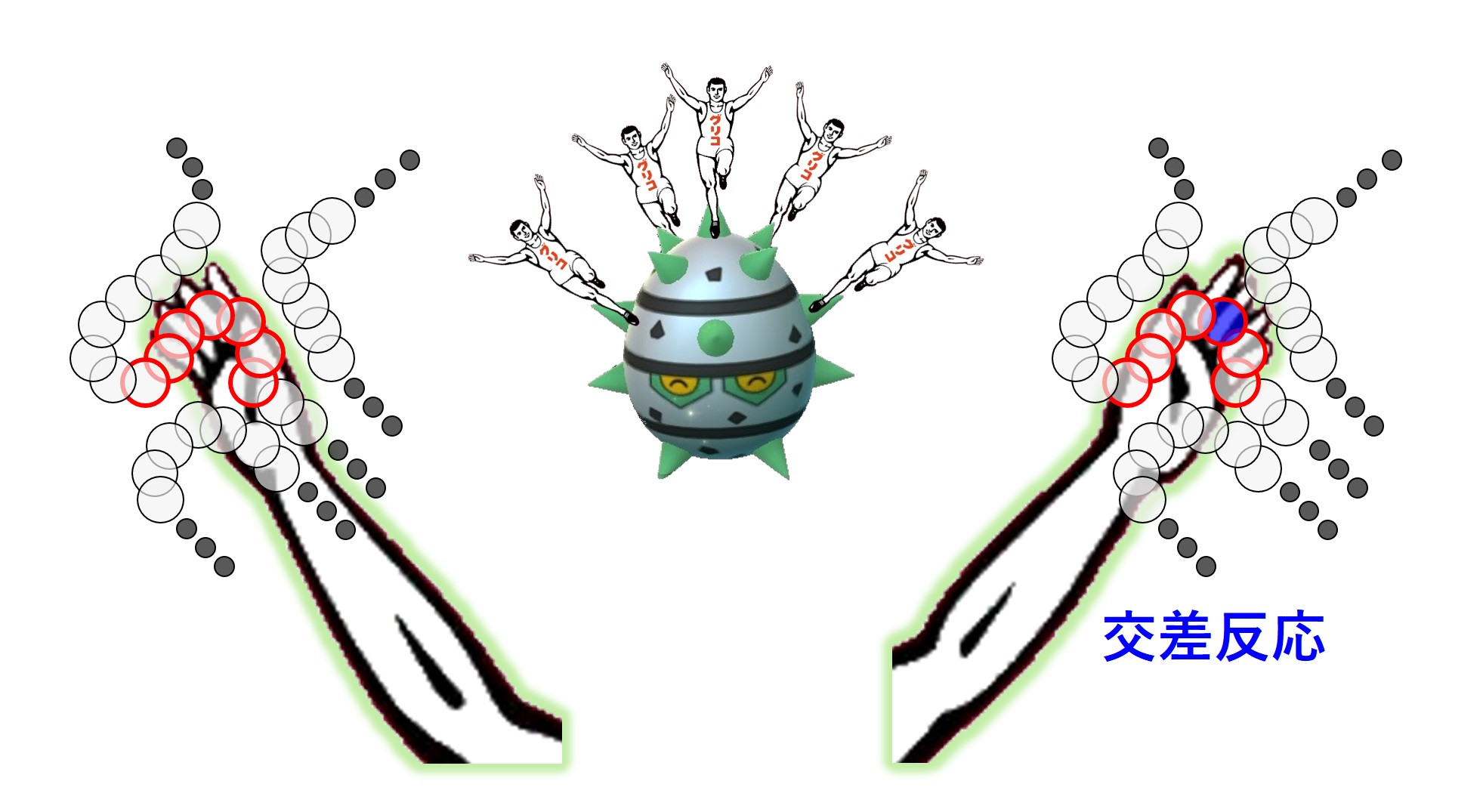
また、コロナウイルスの1個のスパイクは、約1300個のアミノ酸が連なり、複雑に折りたたまれており(折り畳まれるときに3つのスパイクが合体してひと塊になります:三量体)、その構造の一部としてエピトープがあるので、エピトープも立体構造を持っています。そのため、折れ曲がった状態の「あるエピトープ」と結合する抗体は、そのエピトープが真っ直ぐに伸びた状態だと強く結合できない可能性があります。
エピトープのアミノ酸配列順序だけでなく、その立体構造も抗体との結合力に影響します。
さらに、エピトープ自身のアミノ酸に変化が無くても、周りの隣接するアミノ酸の変化により電気的な影響を受けて抗体の結合力が弱まったり、スパイクに付いている糖鎖に結合を妨害される可能性もあります。

一方、細胞性免疫が識別するのは「MHC+ペプチド抗原」ですが、液性免疫の抗体が認識するエピトープに相当するものは、異種タンパクだと 8 個以上(~ 30 個)のアミノ酸が連なった長いペプチド(小さなタンパク)です。その中の1個や2個のアミノ酸が変化したためにまったく認識できなくなることは少ないと考えられます。
(参照:細胞性免疫における感染細胞殺し:▶ ▶ ▶)
しかもスパイクの内部にある立体的な構造の状態で認識するのではなく、異種ペプチドのみが単独で切り出されMHCの籠(かご)の中に安置された状態で認識されるので、元のスパイクの中での立体構造の影響を受けませんし、もちろん(スパイクの中での)周囲のアミノ酸変化の影響も受けません。
スパイクの変異の激しいコロナウイルスに対して、免疫系が(液性免疫に頼らないで)自然免疫と細胞性免疫に頼って身体の防衛を頑張るのは、理にかなったことなのです。
ただし液性免疫は、抗体に柔軟性を持たせるために体細胞超変異(somatic hypermutaion)という小技を使うことがあります。
要するに(同じ抗原刺激が続く場合にも)作る抗体に多様性を持たせ、ちょっとした変異ならカバーできるようにする小技が ハイパーミューテーション です。
しかし、コロナウイルスの免疫逃避能力の方が勝っていて、2歩も3歩も先へ変異していくので、この小技は大きな効果を得ることはできていないようです。
ウイルスに対する免疫応答の仕組み(1) コロナ制圧タスクフォース (2020.02.09) 河本宏
ウイルスに対する免疫応答の仕組み(2) コロナ制圧タスクフォース (2020.05.11) 河本宏